Kimyasal reaksiyonların enerjisi, kimyasal reaksiyonlarda meydana gelen dönüşümleri anlamamızı sağlayan önemli unsurlardan biridir. Böyle bir dönüşüm sırasında, yapıldıkları hammaddelerden farklı yapı ve kimyasal bileşime sahip kimyasal bileşikler üretilir. Bir kimyasal reaksiyon sırasında, reaktan olarak kullanılan moleküllerin atomları arasındaki bağlar kopar ve ürünlerde bulunan yeni bağlar üretilir.

Bir kimyasal reaksiyonun sistemi ve ortamı
Bir kimyasal reaksiyonun enerji açısından doğru yorumlanması için aşağıdakiler hakkında biraz bilgi sahibi olmamız gerekir:
- Sistem: net sınırları olan ayrılmış bir madde alanı. Sistemin tipi önemlidir: Reaksiyon enerji ve madde alışverişini içeriyorsa açık, yalnızca enerji alışverişini içeriyorsa kapalı veya enerji veya madde değiş tokuşu yoksa izole edilmiştir.
- Çevre: Sisteme dahil olmayan ancak yakınlarda bulunan her şey.
- Sistem bileşenleri: Analiz edilen sistemde bulunan ve karakteristik kimyasal özelliklere sahip olan tüm maddeler.
Kimyasal bağların enerjisi
Herhangi bir kimyasal reaksiyonu karakterize eden enerji etkisi, atomlar arasında kopup yeni bağlar oluştururken meydana gelen değişikliklerin sonucudur. Gerçek şu ki, bir kimyasal bağın her kırılması özünde uygun miktarda enerjinin emilmesiyle bağlantılıdır, oysa yeni bir bağın oluşumu enerji üretimine neden olur. Enerjinin çevreye salınmasının farklı etkileri olabilir: ısı, ışık, iş veya elektrik. Bu süreçlerin her biri, reaksiyonun gerçekleştiği sistemin iç enerjisindeki genel değişimi etkileyen bir bileşen faktördür. Reaktiflerin dönüşüm sırasında enerji çekmesi veya vermesi gerekip gerekmediğine bakılmaksızın, tüm süreci başlatmak için her zaman belirli bir miktarda enerjinin gerekli olması önemlidir.
Termodinamiğin birinci yasası
Kimyasal reaksiyonların enerjisi ile ilgili ilk önemli kural, termodinamiğin birinci yasasında formüle edilen ve yalnızca çevre ile enerji alışverişi yapan bir sistemin (kapalı bir sistem) iç enerjisinin ancak ısıya veya işe dönüştürülebileceğini belirten ilişkidir. Bu, Helmholtz denkleminde yansıtılır: ∆U = Q + W Burada ΔU iç enerjideki değişimi, Q ısıyı ve W iş anlamına gelir. İzole edilmiş, yani çevre ile enerji veya kütle alışverişi yapmayan bir sistemin iç enerjisinin sabit olduğunu formülden görebiliriz. İç enerjinin bileşenleri, şu anda reaksiyon sisteminde bulunan atomların, iyonların, moleküllerin, elektronların ve atom çekirdeğinin bileşenlerinin tüm kinetik enerjilerinin yanı sıra bunların etkileşimlerinin enerjileri, yani kimyasal bağların, etkileşimlerin enerjileridir. ücretler arasında vb. Lütfen iç enerjinin bir bütün olarak sistemin kinetik veya potansiyel enerjisini içermediğini unutmayın. Sistemin bir bütün olarak kinetik ve potansiyel enerjileri ile iç enerjisinin toplamı, sistemin toplam enerjisini (E) verir.
Sistem entalpisi (H)
Bu, pratikte sistemin iç enerjisinin toplamı ile basınç ve hacminin çarpımı anlamına gelen kimyasal reaksiyonların enerjisiyle ilgili bir başka önemli kavramdır. Niteliksel olarak, vakumda bir sistem üretmek için gereken enerjidir (U), iş ile artar, yani basınç ve hacim bölümü (pV), sistemin olduğundan farklı bir hacim elde etmek için dış kuvvetlere karşı gerçekleştirmesi gerekir. sıfır. Bir sistemin entalpisini tanımlayan ilişki şu şekilde ifade edilir: H = U + pV Böyle bir sistemde meydana gelen bir reaksiyon, entalpide sonsuz küçük bir değişikliğe neden olur: dH = dU + dpV + pdV Eğer reaksiyon koşulları izobarik ise, yani süreç değişmez, dpV=0 olduğu için ikinci kısım atlanabilir. Belirli artışların yerine diferansiyelleri koyduktan ve sistemin iç enerjisinin değişimine atıfta bulunan ifadeyi değiştirdikten sonra, aşağıdaki ilişkiyi elde ederiz: ∆H = Q + W + p∆V Analiz edilen sürecin sabit bir basınçta hacimsel bir iş yaptığını varsayarsak , sonra W = -pΔV ve sonuç olarak: ∆H = Q – p∆V + p∆V Denklemden, eğer reaksiyon sabit bir basınçta gerçekleşirse, sistemin entalpisindeki değişimin ısıya eşit olduğu sonucu çıkar: ∆H = S
Bir reaksiyonun enerjik yetenekleri
Yukarıda türetilen ve sistemin entalpisindeki değişimin reaksiyon ısısına eşit olabileceğini gösteren formüle dayanarak, işlemler termal dönüşümlere göre sınıflandırılır. Enerji akışının yönü açısından, kimyasal reaksiyonları aşağıdakilere ayırırız:
- Ekzotermik reaksiyonlar, sistemin çevresine örneğin ısı şeklinde enerji yayılımını gözlemleyebileceğimiz reaksiyonlardır. Bu, ürünlerin entalpilerinin toplamı, substratların entalpilerinin toplamından daha düşük olduğunda, yani ΔH<0 olduğunda olur.
- Endotermik reaksiyonlar, yani çevreden enerjinin emilmesine neden olan bu tür kimyasal reaksiyonlar. Böyle bir reaksiyonun koşulu, o enerjinin uygun bir miktarının iletilmesidir. Bu, ürünlerin toplam entalpisinin substratların toplam entalpisinden daha yüksek olduğu, dolayısıyla ΔH>0 olan tüm dönüşümler için geçerlidir.
Kimyasal reaksiyonların gösterimleri
Enerji talepleri ve dağılımları ile birlikte kimyasal reaksiyonları göz önünde bulundurarak, özgül ısı etkileri bir kimyasal denklemin notasyonuna dahil edilir. Ekzotermik reaksiyonlar için ürün tarafında mevcut ısı etkisinin mutlak değeri not edilir. Tersine, bir endotermik reaksiyon not edilirken, emilen enerjinin mutlak değeri alt-tabaka tarafında not edilir. Örnek vermek gerekirse:
- Egzotermik reaksiyon:
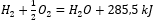
- Endotermik reaksiyon: 2H 3PO 4 + 3Mg(OH) 2 + 407kJ = Mg 3 (PO 4 ) 2 + 6H2O
Başka bir yol, bir kenara verilen enerji etki değeri ile birlikte bir kimyasal denklemi not etmektir. Bu durumda, bir ekzoenerjik reaksiyonun enerjisini temsil eden değer negatifken, bir endoenerjik reaksiyon için pozitiftir. Örneğin:
- Ekzoenerjik reaksiyon: Fe + S → FeS ∆H= -95,2 kJ/mol
- Endoenerjik reaksiyon: FeS → Fe + S ∆H= 95,2 kJ/mol
Hess yasası
Reaksiyonun nasıl yürütüldüğüne bakılmaksızın ısı etkisinin her zaman aynı olduğunu belirten termokimyasal hesaplamalar için bir temel oluşturur. Bu, 10 5 Pa’lık bir basınç ve herhangi bir sıcaklık olan standart koşulların kullanıldığını varsayarak, bir reaksiyonun standart entalpisini (Δ rH ϴ ) hesaplamamızı sağlar. Entalpi, durumun bir fonksiyonu olduğundan, değişkenliği yalnızca iki değere bağlıdır: kimyasal bir reaksiyonda sırasıyla substratların durumunu ve ürünlerin durumunu temsil eden başlangıç ve son hallerde. Hess yasası, stekiometrik katsayıları (v) ve standart molar oluşum entalpilerini ( Δ fH ϴ ) içeren bir denklemle ifade edilir: 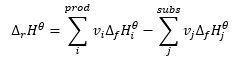
Standart molar oluşum entalpisi
Belirli bir kimyasal bileşiğin 1 molünün temel hallerindeki elementlerden oluşmasıyla elde edilen bir entalpidir. Temel durum, belirli koşullarda elemanın en dayanıklı çeşididir. Örnek verecek olursak grafit , 25 o C ve 10 5 Pa’da karbonun en dayanıklı çeşididir . Tersine, yüksek sıcaklık ve basınçta kararlı bir karbon şekli elmastır. Bir reaksiyona temel durumunda katılan her reaktan için, standart molar oluşum entalpisinin değeri sıfırdır. Genellikle bunlar, soy gazların bireysel atomları veya belirli koşullarda diğer gazların en dayanıklı varyantlarıdır. Standart bir basınç (10 5 Pa) ve sıcaklık (normalde 25 o C) için, bileşiklerin standart molar oluşum entalpilerinin değerleri kimyasal tablolarda toplanır. Bu değerin birimi dir. Kimyasal reaksiyonlara uygulanan Hess yasası, reaksiyonun entalpi değerinin ara reaksiyonların sayısından bağımsız olduğunu ima eder. Tek anahtar bilgi, belirli alt tabakaların belirli ürünleri elde etmek için kullanıldığıdır.
karbondioksit sentezi
Karbondioksit sentezi çeşitli şekillerde gerçekleştirilebilir, ancak Hess yasasına göre her biri standart entalpilerde aynı değerde değişikliklere yol açar.
- Doğrudan sentez
- Karbon (II) oksidin sentezi + bileşiğin karbon (IV) oksite oksidasyonu
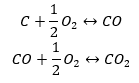 Bileşiklerin standart oluşum entalpilerinin değerlerini tablodan okuyup kimyasal denklemlerde yerine koyduğumuzda, her yöntemin entalpisinin aynı olduğunu göreceğiz: -393.5 kJ/mol.
Bileşiklerin standart oluşum entalpilerinin değerlerini tablodan okuyup kimyasal denklemlerde yerine koyduğumuzda, her yöntemin entalpisinin aynı olduğunu göreceğiz: -393.5 kJ/mol.
Kirchhoff yasası
Farklı bir sıcaklıktaki değerini biliyorsak, belirli bir sıcaklıktaki bir reaksiyonun standart entalpisini hesaplamak için hesaplamaları dönüştürmemizi sağlar. Ayrıca tüm reaktanların molar ısısı ile sıcaklık arasındaki ilişkileri de biliyoruz. Reaksiyonun entalpisindeki değişiklik belirlendiği koşullara bağlı olduğundan yasa uygulanabilir: değişen sıcaklık ve basınçla birlikte değişir. Formülün türetilmesi, sağlanan ısının sıcaklıktaki artışa oranı olan termal kapasite tanımlanarak başlatılmalıdır: ![]() İzotermal koşulları varsayarsak, aşağıdaki dönüşümü yapabiliriz:
İzotermal koşulları varsayarsak, aşağıdaki dönüşümü yapabiliriz: ![]() Ortaya çıkan denklemin entegrasyonu ve termal kapasitenin standart termal kapasitedeki değişimi temsil eden kısma dönüştürülmesi, Kirchhoff yasası tarafından sağlanan denklem tarafından yansıtılır:
Ortaya çıkan denklemin entegrasyonu ve termal kapasitenin standart termal kapasitedeki değişimi temsil eden kısma dönüştürülmesi, Kirchhoff yasası tarafından sağlanan denklem tarafından yansıtılır: 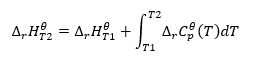 Standart koşullar için, bir reaksiyonun termal kapasitesindeki değişiklik, belirli bir reaktanın standart molar ısısını temsil eden stekiometrik faktörler olan v-değişkenli denklem ile tanımlanır. Sıcaklık farkı küçük olduğunda (100K’ye kadar), reaktanın standart molar ısısının değerinin belirli bir aralıkta sabit olduğu varsayılır. O halde, reaktanların termal kapasitelerinin sıcaklığa değil sabit basınca bağlı olduğunu varsayarak, Kirchhoff yasasının basitleştirilmiş biçimini kullanabiliriz:
Standart koşullar için, bir reaksiyonun termal kapasitesindeki değişiklik, belirli bir reaktanın standart molar ısısını temsil eden stekiometrik faktörler olan v-değişkenli denklem ile tanımlanır. Sıcaklık farkı küçük olduğunda (100K’ye kadar), reaktanın standart molar ısısının değerinin belirli bir aralıkta sabit olduğu varsayılır. O halde, reaktanların termal kapasitelerinin sıcaklığa değil sabit basınca bağlı olduğunu varsayarak, Kirchhoff yasasının basitleştirilmiş biçimini kullanabiliriz: ![]()
