Bu, çeşitli elementlerin oksijenle birleşmesiyle oluşan bir grup inorganik bileşiktir. Genel formülleri X n O m'dir , burada "X" herhangi bir elementtir, "O" oksijendir, her zaman ikinci oksidasyon durumundadır ve alt indeksteki "n,m" harfleri katsayılardır. Oksit örnekleri: su H20 , potasyum oksit K20 , alüminyum oksit Al203 , kalsiyum oksit CaO ve karbon (II) monoksit CO.

oksitlerin sınıflandırılması
Oksitler birkaç kategoriye ayrılabilir. En genel sınıflandırma, metal oksitler, örneğin lityum oksit, magnezyum oksit, alüminyum oksit, demir oksit ve karbon oksit, nitrojen oksit, kükürt oksit ve klor oksit dahil olmak üzere metal olmayan oksitler arasındaki ayrımdır. Diğer bir kriter ise fiziksel durumlarına göre sınıflandırmadır. Hemen hemen tüm metal oksitler ve bazı ametaller (SiO 2 , P 4 O 10 ) katıdır. Su, kükürt (VI) oksit ve manganez (VII) oksit sıvıdır. CO, CO 2 , SO 2 , NO i NO 2 gibi metal olmayan oksitler gazlardır. Oksitler ayrıca içlerinde oluşan bağların türüne göre de sınıflandırılabilir. Magnezyum oksit MgO, kalsiyum oksit CaO veya sodyum oksit Na20 , O2- iyonları ve iyonik bağlar içerir, bu nedenle adları iyonik oksitlerdir. Başka bir grup kovalent oksitlerdir, örneğin karbon (II) monoksit CO, nitrik (II) oksit NO veya kükürt (IV) oksit S02 olup, burada oksijen atomu ile element arasındaki bağ polar bir kovalent bağ formuna sahiptir.
Oksitlerin kimyasal karakteri
Kimyagerler için en ilginç sınıflandırma, oksitlerin kimyasal doğasına dayanmaktadır. Dört ana oksit kategorisi vardır – asidik, bazik, nötr ve amfoterik.
- Bazen asit anhidritler olarak da adlandırılan asidik oksitler , alkalilerle tuz oluşumu ile reaksiyona girmeleri ile ayırt edilirler. Asidik oksitlerin önemli bir kısmı suda çözündükten sonra uygun oksiasit çözeltileri oluşturur. Bu, örneğin suda çözündüğünde sülfürik (IV) asit oluşturan kükürt (IV) oksit ve kromik (VI) aside çözünen krom (VI) oksit için geçerlidir:
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 Suda çözünmeyen küçük bir asidik oksit grubu vardır. Ancak bunlar, silikon gibi güçlü alkalilerin çözeltilerinde çözünürler ( IV) oksit Si02 , molibden (VI) oksit Mo03 ve tungsten (VI) oksit WO3 . Alkalilerle reaksiyonları asidik karakterlerini doğrular: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O As a Kural olarak, asidik oksitler, metal olmayan oksitler ve mümkün olan en yüksek oksidasyon durumlarındaki metal oksitlerdir. Belirli bir element, örneğin krom gibi, farklı oksidasyon durumlarında birkaç oksit oluşturuyorsa, oksitlerinin asidik özellikleri, oksidasyon durumunun artmasıyla birlikte artar:
- krom (II) CrO oksit alkalidir,
- krom (III) oksit Cr203 amfoterik özelliklere sahiptir ,
- krom (VI) oksit CrO3 asidiktir.

- Alkalik oksitler, karşılık gelen tuzlar şeklinde ürünler vermek üzere asitlerle reaksiyona giren metallerle oksijen bileşikleridir. Bazıları, yani berilyum hariç, periyodik tablonun birinci ve ikinci grubundaki elementlerin oksitleri de alkalik hidroksitlerin oluşumuyla sonuçlanan suyla reaksiyona girmeleri ile karakterize edilir. Örneğin, sodyum oksit, lityum oksit ve baryum oksitin suyla reaksiyonu sırasında oluşur:
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 Suda çözünmeyen, sadece asit çözeltilerinde çözünen alkali oksitler de vardır. Bunlara örneğin manganez (II ) oksit ve demir (II) oksit dahildir: MnO + H2S04 → MnSO4 + H20 FeO + 2HCl → FeCl2 + H20
- Nötr oksitler, oksitlerin en az reaktif grubudur. Asitlerle veya alkalilerle reaksiyona girmezler. Suda da çözünmezler. Bu oksit grubunun örnekleri, karbon (II) monoksit CO ve nitrik (II) oksit NO’dur.
- Amfoterik oksitler, nötr oksitlerin tam tersidir ve aynı anda hem asidik hem de alkalidir. Bu, hem güçlü alkalilerle hem de asitlerle reaksiyona girdikleri anlamına gelir. Bu reaksiyonların ürünleri her zaman tuzlardır ve başlangıçta oksijenle birleşen element, asit kalıntısının uygun bir katyonuna veya anyonuna dönüştürülür. Nötr oksitlerle tek benzerlikleri suda zayıf çözünürlükleridir. Amfoterik oksit örnekleri şunlardır : berilyum oksit BeO, alüminyum oksit Al203 , krom (III) oksit, kalay (II) oksit SnO, kurşun (II) oksit PbO ve çinko oksit ZnO. Güçlü alkalilerin sulu çözeltileriyle, örneğin sulu bir sodyum hidroksit çözeltisiyle reaksiyona girerek kompleks tuzlar oluştururlar. Asit kalıntılarında, oksitten türetilen metalin atomları veya iyonları, uygun sayıda hidroksil grubu ile kompleksler halinde bulunur. Sayıları, verilen elemanın koordinasyon numarasına bağlıdır. Örneğin, berilyum oksit BeO gibi MO (M – metal) oksitlerden türetilen atomların koordinasyon numarası 4’tür . M2O3 tipi oksitlerden türetilen atomlar, örneğin Al2O3 , iki farklı koordinasyon numarasına sahip olabilir ve reaksiyon koşullarına bağlı olarak 4 veya 6’dır. Amfoterik oksitlerin örnek reaksiyonları:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] sodyum tetrahidroksi zinkat Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] potasyum tetrahidroksialüminat Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] sodyum hekzahidroksialüminat Bazı oksitler çinko oksit ve manganez (IV) oksit gibi oldukça spesifik amfoterik özelliklere sahiptir. İkincisi, ne normal ne de standart koşullar altında alkalilerle reaksiyona girmez. Öte yandan her ikisi de katı alkalilerle kaynaşarak onlarla reaksiyona girer, örneğin: 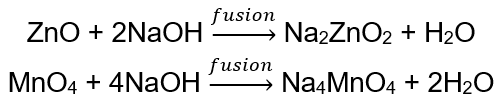

oksitlerin elde edilmesi
- Elementlerin doğrudan sentezi: a) kükürt (IV) oksit S + O → S02 oluşumu ile kükürt atomlarının ve oksijen atomlarının sentezi b) magnezyum oksit 2Mg + O2 → 2MgO oluşumu ile magnezyum atomlarının ve oksijen atomlarının sentezi c) karbon (IV) monoksit C + O2 → CO2 oluşumu ile karbon atomlarının ve oksijen atomlarının sentezi
- Tuzların , hidroksitlerin ve oksitlerin termal ayrışması: a) kalsiyum karbonatın kalsiyum oksit ve karbon (IV) monoksite ayrışması CaCO 3 → CaO + CO 2 b) bakır (II) hidroksitin bakır (II) oksit ve suya ayrışması Cu( OH) 2 → CuO + H 2 O c) manganez (IV) oksidin manganez (III) oksit ve oksijene ayrışması 4MnO 2 → 2Mn 2 O 3 + O 2
- Düşük oksidasyon durumlarında oksitlerin değerlerinde bir artışla oksidasyonu: a) kükürt (IV) oksidin kükürt (VI) okside oksidasyonu 2SO2 + O2 → 2SO3 b) nitrik (II) oksidin nitrik oksidasyonu ( IV) oksit 2NO + O 2 → 2NO 2 c) karbon (II) monoksitin karbon (IV) monoksite (IV) 2CO + O 2 → 2CO 2’ye oksidasyonu
- Oksitlerin daha yüksek oksidasyon durumlarında, değerlerinde bir azalma ile indirgenmesi: a) karbon (IV) monoksitin karbon (II) monoksite (II) CO 2 + C → 2CO’ya indirgenmesi b) kalay (II) oksidin kalaya indirgenmesi (I) oksit 2SnO + O 2 → 2SnO 2
- Organik bileşiklerin yanması: a) karbon (IV) monoksit ve su oluşumu ile oksijende metan yanması CH4 + 2O2 → CO2 + 2H20 b) nitrik (II) oksit elde etmek için amonyağın oksijende yanması ve su 4NH 3 + 5O 2 → 4NO + 6H 2 O
- Kararsız oksiasitlerin reaksiyonu: a) karbonik (IV) asidin karbon (IV) monoksit ve suya ayrışması: H2CO3 → CO2 + H20 b) sülfürik (IV) asidin kükürt (IV) okside ayrışması ve su: H 2 SO 3 → SO 2 + H 2 O






















































































































