pH ölçeği, 0 ila 14 arasındaki mutlak sayıları içeren nicel bir ölçekte bir çözeltinin asitlik veya alkalilik derecesini belirlemek için kullanılır. Hidronyum iyonlarının [H 3 O +] molar aktivitesine dayanır. Test edilen sıvıda. Ölçek 1909'da Danimarkalı biyokimyacı S. Sorensen tarafından geliştirildi ve 'p' ve 'H' harfleri sırasıyla Latince 'potentio' (güç) ve periyodik tabloda gösterilen hidrojen atomunu temsil ediyor. 'H' (hidrojenyum) olarak. pH ölçeği hem birini hem de diğerini yansıtır: pH seviyesini belirlemek için, hidrojen içeren protonlara atıfta bulunmak için değiştirilmiş işaretli güç üssünü kullanırız. Üretilen herhangi bir çözeltinin pH seviyesi, onun en önemli kimyasal özelliklerinden biridir ve üretilen maddelerin türü kadar birçok kimyasal reaksiyonun seyrini ve hızını belirleyen bir faktördür.

Ölçekte farklılaşma
pH ölçeği, ortadaki değerin (7) nötr bir pH’ı gösterdiği on beş derece içerir. 0’a yakın olan çözeltiler kuvvetli asitler olarak adlandırılırken, karşı taraftaki 14’e yakın olan çözeltiler kuvvetli bazlar olarak adlandırılır. Asidik bir pH, çözeltinin çok fazla hidrojen iyonu [ H3O +] içerdiği anlamına gelir ve bazik bir pH, çok fazla hidroksit iyonu [OH –] olduğu anlamına gelir. pH ölçeğine çoğunlukla çözeltiler bağlamında atıfta bulunulur, ancak bir protonun mutlak kimyasal potansiyeli, onu tüm kümelenme durumlarında uygulanabilir kılar. Bu, hemen hemen her maddenin alkalilik seviyesini doğrudan karşılaştırmamızı sağlar.
Suyun kendi kendine ayrışması
pH ölçeğinin anlamını tam olarak anlamak için, aşağıdaki denkleme göre ilerleyen suyun kendi kendine ayrışmasının kendiliğinden reaksiyonuna ihtiyacımız var:  Denge sabiti denklemin sol tarafına, yani ayrışmamış suya doğru kaydırılan, tersine çevrilebilir bir süreçtir.
Denge sabiti denklemin sol tarafına, yani ayrışmamış suya doğru kaydırılan, tersine çevrilebilir bir süreçtir.
pH seviyesi nasıl hesaplanır?
Belirlemenin [H +] hidrojen iyonlarının konsantrasyonuyla ilgili olduğu şeklindeki hatalı tanımlanmış ilk varsayıma rağmen, en popüler formül hala aşağıdaki gibidir:  Bugün, çözeltilerin sulu hidrojen iyonları, yani suda bulunan protonları, ani çözme işlemi nedeniyle içermediğini zaten biliyoruz. Bu fenomen, serbest protonların yokluğu ve hidronyum iyonlarının [ H30 +] varlığıyla sonuçlanır, bu da spontane, geri dönüşü olmayan reaksiyondan kaynaklanır:
Bugün, çözeltilerin sulu hidrojen iyonları, yani suda bulunan protonları, ani çözme işlemi nedeniyle içermediğini zaten biliyoruz. Bu fenomen, serbest protonların yokluğu ve hidronyum iyonlarının [ H30 +] varlığıyla sonuçlanır, bu da spontane, geri dönüşü olmayan reaksiyondan kaynaklanır: 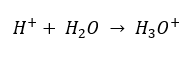 Bu nedenle, formülün doğru gösterimi aşağıdaki gibidir:
Bu nedenle, formülün doğru gösterimi aşağıdaki gibidir: 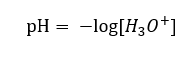
pH ölçeğinde belirtilen ortam
Oda sıcaklığında (25 o C) saf sudaki hidronyum iyonlarının konsantrasyonunun 10 -7 mol/dm 3 olduğu kabul edildiğinden pH değeri aşağıdaki gibi hesaplanabilir: 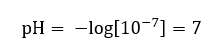 Bu, nötr olan suyun, maddenin kimyasal inertliğini gösteren ölçeğin ortasında konumlandırılmasıyla uyumludur. Ayrıca suyun eşit sayıda hidroksit anyonu ve hidronyum katyonu içerdiğini kanıtlar. Ancak asitlerde ve bazlarda bu denge bozulur. Negatif bir üs, pH seviyesi ne kadar düşükse, test edilen çözeltinin gücünün o kadar yüksek olduğu bir ilişkiyi akla getirir. pH ölçeği bağlamında ‘güç’ terimi, 0 değerinin güçlü, hatta tahriş edici asitler tarafından alınmasına, 14 değerinin ise en güçlü alkalin maddelere karşılık gelmesine karşılık gelir.
Bu, nötr olan suyun, maddenin kimyasal inertliğini gösteren ölçeğin ortasında konumlandırılmasıyla uyumludur. Ayrıca suyun eşit sayıda hidroksit anyonu ve hidronyum katyonu içerdiğini kanıtlar. Ancak asitlerde ve bazlarda bu denge bozulur. Negatif bir üs, pH seviyesi ne kadar düşükse, test edilen çözeltinin gücünün o kadar yüksek olduğu bir ilişkiyi akla getirir. pH ölçeği bağlamında ‘güç’ terimi, 0 değerinin güçlü, hatta tahriş edici asitler tarafından alınmasına, 14 değerinin ise en güçlü alkalin maddelere karşılık gelmesine karşılık gelir.
Suya asit eklenmesi
Nötr bir seviyeden pH değişikliğine, farklı güçlere sahip maddeler eklenerek neden olabilir. Örneğin, en güçlü asitlerden birini ( hidroklorik asit, HCl ) suya eklersek, asidin aşağıdaki reaksiyona göre ayrışmasına neden olur:  Suyun kendi kendine ayrışmasının aksine, asit ayrışmasının dengesi önemli ölçüde sağa kaydırılır. Bu nedenle, bu asit çevresel olarak inert suda çözülürse, suda bulunan hidronyum iyonlarının miktarını artıracak ve sonuç olarak molar aktivitelerini artıracaktır. Bir örnek vermek gerekirse, ayrışma reaksiyonuna göre, 1 mol/ dm3’te konsantre edilen hidroklorik asit çözeltiye 1mol/ dm3’te konsantre hidronyum iyonları verir. Böyle bir hidroklorik asit çözeltisinin pH seviyesi aşağıdaki formüle göre hesaplanabilir:
Suyun kendi kendine ayrışmasının aksine, asit ayrışmasının dengesi önemli ölçüde sağa kaydırılır. Bu nedenle, bu asit çevresel olarak inert suda çözülürse, suda bulunan hidronyum iyonlarının miktarını artıracak ve sonuç olarak molar aktivitelerini artıracaktır. Bir örnek vermek gerekirse, ayrışma reaksiyonuna göre, 1 mol/ dm3’te konsantre edilen hidroklorik asit çözeltiye 1mol/ dm3’te konsantre hidronyum iyonları verir. Böyle bir hidroklorik asit çözeltisinin pH seviyesi aşağıdaki formüle göre hesaplanabilir: 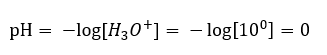
Suya baz eklenmesi
Tersine, suya güçlü bir baz eklediğimiz olayda, hidronyum iyonlarının konsantrasyonu düşecektir. Örneğin, 1 mol/ dm3’te konsantre sodyum hidroksit , benzer şekilde, suyun etkisi altında girdiği reaksiyona göre aynı konsantrasyona ancak diğer iyonlara (hidroksit iyonları) sahip olacaktır:  Böyle bir durumda, aşağıdaki ek pOH formülünü kullanarak pH’ı dolaylı olarak hesaplamak mümkündür:
Böyle bir durumda, aşağıdaki ek pOH formülünü kullanarak pH’ı dolaylı olarak hesaplamak mümkündür: 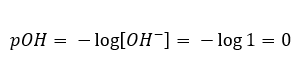 Bunu bilirsek:
Bunu bilirsek: 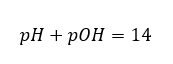 1 mol/ dm3’te konsantre edilmiş güçlü bir baz (NaOH) çözeltisinin pH’ının 14 olduğunu kolayca hesaplayabiliriz.
1 mol/ dm3’te konsantre edilmiş güçlü bir baz (NaOH) çözeltisinin pH’ının 14 olduğunu kolayca hesaplayabiliriz. 
Ölçeğin dışındaki pH seviyesi?
pH ölçeği başlangıçta seyreltilmiş çözeltiler için geliştirildiğinden, güçlü asitlerin veya bazların 0’ın altına veya 14’ün üzerine çıkarak onu aşması mümkündür. Bunun nedeni, ölçeğin pH’ın artık logaritmik olmadığı yüksek konsantrasyonlar için kullanışsız olmasıdır. hidronyum iyonlarının işlevi [H 3 O +]. Daha sonra, asitlerin ve bazların ayrışmasının sabit dengelerinden kaynaklanan farklı değerler kullanırız.
Çözeltinin pH değerini belirleme yöntemleri
Bir ortamın pH’ını ampirik olarak belirlemek için asit-baz göstergeleri olarak adlandırılan göstergeleri kullanırız. Pratikte farklı pH koşullarından etkilendiklerinde renk değiştiren maddelerdir. Üç tür gösterge vardır:
- Temel bir ortamda rengini değiştiren göstergeler, örneğin:
- renksiz fenolftalein ahududu rengine dönüşür,
- renksiz timolftalein maviye döner.
- Asidik ortamda renk değiştiren göstergeler, örneğin:
- metil portakal rengini turuncudan kırmızıya değiştirir,
- bromotimol mavisi rengini maviden sarıya değiştirir.
- Evrensel göstergeler, örneğin:
- bromotimol mavisi asitlerde sarıya, bazlarda maviye döner,
- lakmus asitlerde kırmızıya, bazlarda maviye döner.
Turnusol kağıtlarını, pH seviyeleri aralığını artıran farklı gösterge maddelerinin bir karışımına batırmak da yaygındır. Ek olarak, birçok laboratuvar renkleri kırmızıdan yeşile değiştiren hazır evrensel turnusol kağıtları kullanır ve beraberindeki bir ölçeğe göre test edilen pH’ı uygun şekilde önerir. Bu belirleme, pH ölçeğinde sadece 0,5 birimlik bir doğrulukla pH değerini tahmin etmemizi sağlar. pH değerini ölçmenin daha kesin bir yöntemi, alkalimetri (standartlaştırılmış bir baz çözeltisiyle titrasyon) ve asidimetrinin (standartlaştırılmış bir asit çözeltisiyle titrasyon) alt tiplerini içeren asit-baz titrasyonudur. Test edilen madde ile reaksiyona girdiğinde çözeltide bulunan hidronyum iyonlarının konsantrasyonunu sürekli olarak değiştiren, bilinen bir konsantrasyona sahip bir titrant kullanır. Bu belirleme iki şekilde gerçekleştirilebilir: görsel olarak, bitiş noktası belirlenirken, renk değişimi ile birlikte veya örneğin potansiyometri veya kondüktometri gibi enstrümantal yöntemlerin kullanımıyla. Adından da anlaşılacağı gibi pH metre kullanımı, maddenin pH değerini belirlememizi de sağlar. Potansiyometriye dayalı olarak çalışan alet, iki özdeş elektrotta bir hücreye sahiptir. Gösterge elektrot adı verilen bunlardan biri test edilen çözeltiye konmalıdır. Diğeri (karşılaştırmalı elektrot), bilinen bir pH değeri ile standart çözeltiye yerleştirilir. Yaygın olarak kullanılan bir madde gümüş klorür çözeltisidir. Her iki elektrot, EMF’yi (elektromotor kuvveti) sürekli olarak pH ölçeğinde belirli bir sonuca dönüştüren son derece hassas bir voltmetre ile bağlanır. Nernst teorisine göre, farklı pH değerlerine sahip çözeltilere daldırılmış iki özdeş elektrottan oluşan hücrenin elektromotor kuvveti (EMF), her iki konsantrasyonun bölümünün logaritması ile doğru orantılıdır.
pH değerini ölçmek için ev yöntemleri
Pek çok doğal pH göstergesi olduğu ve yaklaşık pH değerinin ev ortamında ölçülebildiği ortaya çıktı. Örneğin, siyah çay yapraklarından yapılan bir demleme, örneğin limon suyu gibi bir asitle karıştırıldığında daha parlak hale gelir. Tersine, kabartma tozu çözeltisi gibi bazların etkisi altında koyulaşır. Kırmızı lahana suyunun rengi asitle karıştırıldığında menekşeden kırmızıya, bazla karıştırıldığında maviye döner.
