Kimyasal analizlerde kullanılan en eski enstrümantal yöntemlerden biridir. Temelleri 18. ve 19. yüzyıllar arasında L. Galvani, CA Volta, JW Gibbs ve W. Nernst tarafından atıldı. Potansiyometrik yöntemlerle gerçekleştirilen ölçümler, test edilen çözeltiye batırılmış iki elektrottan oluşan bir hücrenin elektromotor kuvvetini (EMF) kullanır. Bu kuvvetin değeri doğrudan kullanılan elektrotların potansiyellerine bağlıdır. Bunlar da elektrolit çözeltisinde bulunan iyonların aktivitesine ve elektrot işlemlerinin doğasına bağlıdır.
Daniell hücresi tarafından örneklenen elektrot işlemlerinin şeması
Daniell hücresi, her biri kendi tuzunun çözeltisine batırılmış bir metalden oluşan iki yarım hücreden yapılmıştır. Bileşen yarı hücreler, Cu (s) /Cu2 + (aq) ve Zn (s) /Zn2 + (aq) sistemleridir. Her biri aşağıdaki redoks reaksiyonlarından birine maruz kalır:
- kesinti
Cu 2+ (sulu) + 2e – → Cu (k)
- oksidasyon
Zn (s) → Zn 2+ (aq) + 2e – Her iki reaksiyonu birleştirdiğimizde, hücrede meydana gelen reaksiyon için tam denklemi elde ederiz: Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) Hücrenin belirli bir elektromotor kuvvetini ölçmek için, yarım hücreleri bir tuz köprüsü kullanarak bağlamalı ve elektrotları bir voltmetreye bağlamalıyız . Böylece , hücrenin EMF değerini temsil eden, tek tek elektrotlar arasındaki potansiyel farkını ölçebiliriz . IUPAC kuralına göre, Daniell hücresinin diyagramı şu şekilde görünür: ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ Tek çizgiler arayüzü, çift çizgiler ise tuz köprüsünü temsil eder. Arayüzdeki potansiyel, oksidasyon ve indirgeme reaksiyonlarının bir sonucudur. Hücreler için oksidasyonun olduğu elektrotun ϴ işaretli anot, indirgemenin olduğu diğerinin ise pozitif katot olduğunu varsayarız. Gösterim anot ile başlar ve katot sağ tarafta belirtilir . Böyle bir hücrenin elektromotor kuvveti aşağıdaki formüle göre hesaplanabilir: EMF = katot potansiyeli – anot potansiyeli
Standart elektrot potansiyeli
Bu terim, sistematik hale getirmek için kullanılmıştır ve bir elektrotun belirli bir potansiyeli, birkaç koşulu karşılıyorsa "standart" olarak kabul edilir. Ölçüm 298 K’de yapılmalı, aktif iyonların aktivitesi 1 mol/ dm3’e eşit olmalı ve elektrotun potansiyelinin 0,0000 V olduğu varsayıldığından referans elektrot standart bir hidrojen elektrotu olmalıdır.
Hücrenin elektromotor kuvveti
EMF değeri, hücrede bulunan iyonların değişen aktivitesi ile birlikte değişir. Bu ilişkiyi yansıtan denklem Nernst denklemi olarak adlandırılır: 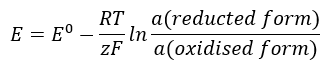 Aşağıdaki sembolleri kullanır: elektrot potansiyeli (E), standart elektrot potansiyeli (E 0 ), 8,312 J/K·mol’e eşit gaz sabiti (R), sıcaklık (T), elektronların elektrokimyasal reaksiyonunda yer alan elektronların sayısı (z), Faraday sabiti (F) 9.64853·10 4 C/mol’e eşittir ve indirgenmiş ve oksitlenmiş formlardaki iyonların aktivitesi. Katılar için aktivitenin (a) 1 olduğu varsayılır.
Aşağıdaki sembolleri kullanır: elektrot potansiyeli (E), standart elektrot potansiyeli (E 0 ), 8,312 J/K·mol’e eşit gaz sabiti (R), sıcaklık (T), elektronların elektrokimyasal reaksiyonunda yer alan elektronların sayısı (z), Faraday sabiti (F) 9.64853·10 4 C/mol’e eşittir ve indirgenmiş ve oksitlenmiş formlardaki iyonların aktivitesi. Katılar için aktivitenin (a) 1 olduğu varsayılır. 
potansiyometrik enstrümantasyon
Potansiyometrik ölçümler için temel set iki bileşenden oluşur: test edilen solüsyona batırılmış bir çift elektrot ve bir ölçüm cihazı . İlk bileşen ölçüm hücresidir , ikincisi ise elektromotor kuvvetinin gerçek ölçümünü sağlar. Bir hücrenin en önemli kısmı elektrotlardır. Etki mekanizmalarına göre dört gruba ayrılabilirler.
Tuz köprüsü
Herhangi bir hücrenin önemli bir unsuru , referans elektrotun test edilen solüsyonla temas etmesini sağlayan tuz köprüsüdür . Aktarımlı bir hücrenin temel özelliği, farklı konsantrasyon ve bileşimlerdeki elektrolitler arasındaki temastır. Köprü elektrolitinin test edilen solüsyonla karışmasını önlemek için küçük temas yüzeyleri kullanılır.
Birinci türden elektrotlar
Bu elektrotlar , kendi iyonlarını içeren çözeltiye batırılmış bir metal veya gazdan yapılır . Bunlar ayrıca katyona tersinir elektrotlar olarak da adlandırılırlar, çünkü yüzeylerinde aşağıdaki tersinir reaksiyon meydana gelir: M 0 ↔ Mn + + ne Birinci türden elektrotlara bir örnek hidrojen elektrodudur.
İkinci tür elektrotlar
Bu tür elektrotlar , az çözünür tuzuyla kaplanmış bir metalden yapılmıştır . Sistem, az çözünen tuzla aynı anyonu içeren serbestçe çözünen bir tuza daldırılır. Bu elektrotlar , ortak anyona tersinir elektrotlar olarak adlandırılır, çünkü yüzeylerinde aşağıdaki reaksiyon meydana gelir: M 0 + A – ↔ MA + e İkinci türden elektrot örnekleri, gümüş-gümüş klorür veya kalomel elektrotları içerir.
Üçüncü tür elektrotlar
Bunlar, iki katmanla çevrili metallerden oluşur: ilk, o metalin idareli çözünür tuzundan yapılmış ince katman ve aynı anyonu içeren biraz daha iyi çözünür tuzdan yapılmış ikinci katman. Ortak katyona ters çevrilebilen elektrotlardır , yüzeylerinde aşağıdaki reaksiyon oluşur: M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
redoks elektrotları
Bu tür elektrotların yapısı , hem indirgenmiş hem de oksitlenmiş formlarda bir madde içeren bir çözeltiye batırılmış platin veya altın gibi kimyasal olarak inert bir metalin kullanılmasıyla karakterize edilir . Bu tür elektrotlara bir örnek, kinhidron elektrottur.
Bir sistemdeki elektrotların işlevleri
Analitik bir sistemdeki uygulama açısından şunları ayırt ederiz:
- ölçüm koşullarından veya test edilen çözeltinin konsantrasyonundan bağımsız olarak sabit bir potansiyeli koruyan referans elektrotlar .
- Test edilen solüsyon hassas oldukları iyonları içeriyorsa potansiyeli değişen indikatör elektrotlar .
referans elektrotları
Potansiyometrik ölçüm , indikatör elektrodun potansiyelinin referans elektrotla karşılaştırılmasına dayanır. Bu nedenle, bu tür elektrotlar aşağıdakilerle karakterize edilmelidir:
- kararlı potansiyel,
- tekrar üretilebilir potansiyel ve sıcaklık bağımsızlığı,
- çok yönlülük ve kullanım kolaylığı,
- düşük elektrik direnci,
- tekrarlanabilir ve düşük difüzyon potansiyeli,
- elektrot elektrolitinin test edilen çözeltiye çok az akışı.
Yaygın olarak kullanılan bir referans elektrot, klorür iyonlarının varlığına tepki veren gümüş-gümüş klorür elektrodudur (Ag/AgCl/KCl). Bir gümüş klorür tabakası ile kaplanmış gümüş bir telden yapılmıştır. Başka bir örnek, potansiyeli bir klorür iyonu çözeltisindeki aktiviteye de bağlı olan kalomel elektrottur (Pt/Hg/ Hg2Cl2 /KCl).
gösterge elektrotları
Bu kategorideki elektrotlar için , çözeltide test edilen iyonların varlığında potansiyel değişimleri . Bu , potansiyellerinin doğrudan yerleştirildikleri çözeltinin aktivitesine ve dolayısıyla konsantrasyonuna bağlı olduğu anlamına gelir. En yaygın olarak kullanılanlar, gümüş, cıva veya hidrojen elektrotları gibi kendi iyonlarının çözeltilerine batırılmış elektrotlardır. Bununla birlikte, modern potansiyometride iyon seçici membran elektrotları kullanılmaktadır. Bazı ortak özelliklere sahiptirler, örneğin, aktif kısımları zardır ve çözeltiden gelen iyonlar ile zar arasındaki iyonik reaksiyon, arayüzlerindeki potansiyel farkını belirler. Bu tür elektrotlar yapılarına göre cam, katı membran, sıvı membran ve çift membran elektrotlara ayrılabilir. En sık kullanılanlar, elektrot camından yapılmış ince cidarlı bir ampul ile sonlandırılan bir cam tüpten yapılan cam elektrotlardır. Sabit bir iyon aktivitesi ile dahili çözeltiye daldırılmış dahili, gümüş-gümüş klorür elektrotu barındırır.
