Spektroskopik yöntemler, elektromanyetik veya korpüsküler radyasyonun incelenen numune ile etkileşimi yoluyla sinyalin üretildiği bir yöntemler grubudur. Bu radyasyon, enerji aktarımıyla ilişkili elektromanyetik alandaki periyodik değişikliklerin bir sonucu olarak ortaya çıkabilir. Bu yöntemler, belirli bir soğurucu veya yayıcı sistemdeki atomların konsantrasyonunu veya içeriğini belirlemek için kullanılır. Ne tür spektrofotometri vardır ve bu yöntemler neler içerir? Makalemizden öğreneceğiniz şey budur.

Radyasyon ve enerji geçişleri
Fotonların veya radyasyon kuantumunun en önemli özelliği enerjidir. Enerji değeri formülü (E), 6,626·10 -34 [J ·s] Planck sabiti (h) ile Hertz [Hz] cinsinden ifade edilen radyasyon frekansının (v) çarpımıdır. 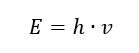 Spektrofotometri, elektromanyetik radyasyonun farklı aralıklarda emilmesi veya emisyonunun neden olduğu moleküllerdeki enerji geçişlerinden yararlanır:
Spektrofotometri, elektromanyetik radyasyonun farklı aralıklarda emilmesi veya emisyonunun neden olduğu moleküllerdeki enerji geçişlerinden yararlanır:
- ultraviyole (UV) 200-380 nm,
- görünür radyasyon (Vis) 380-780 nm,
- yakın kızılötesi (IR) 0,78-30000 μm.
Spektrofotometrinin temel kavramları ve yasaları
İzosbestik nokta
Bu, çözelti içindeki bileşiğin her iki formunun da (ayrışmış ve ayrışmamış) eşit absorpsiyona sahip olduğu, absorbans-dalga boyu sisteminde çizilen eğrilerin kesişiminden kaynaklanan belirli bir dalga boyuna karşılık gelen noktadır. PH’daki bir değişiklik konumu değiştirmez; bir bileşiğin bu tür birçok noktası olabilir.
Kimyasal bir bileşiğin absorpsiyon spektrumu
Spektrum, bileşiğin ışık dalga boyundan (λ) emdiği ışık miktarının bir ölçüsüdür. I 0 şiddetindeki elektromanyetik radyasyon (ışık) bir numunenin üzerine düşerse, bu radyasyonun bir kısmı emilecek ve bir kısmı numunenin içinden geçecektir. Gelen ( I0 ) ve iletilen ( It ) radyasyonun yoğunluklarını kaydederek, çözelti tarafından emilen (absorbans, A) veya içinden geçen (geçirgenlik, T) ışık miktarını belirleyebiliriz.
Absorbans
Absorbsiyon olayını tanımlayan miktar absorbanstır. Bu, serbest atom sayısına göre elektromanyetik radyasyonun yoğunluğunun boyutsuz bir ölçüsüdür. Bu rakam, emilim hacimleriyle ilgili hesaplamaları kolaylaştırmak için sunulmuştur. Emilim, elektromanyetik radyasyon ve madde arasındaki etkileşimdir; enerjinin bir kısmının madde tarafından emilmesidir. Absorbans katkı maddesidir ve bazen optik yoğunluk olarak da adlandırılır. Sembolik olarak Abs veya A olarak kaydedilir. Matematiksel olarak, test numunesine gelen radyasyon ışınının yoğunluğunun (I 0 ), test numunesi boyunca iletilen radyasyon ışınının yoğunluğuna oranının ondalık logaritmasıdır. ( BT ). 0’dan sonsuza kadar değer alabilir. Bu ilişkiyi açıklayan matematiksel ifadeye Beer-Lambert yasası denir. Belirli bir dalga boyundaki emme, emme katsayısına (ε), emici tabakanın kalınlığına (genellikle 1 cm) ve test çözeltisinin konsantrasyonuna bağlıdır.
geçirgenlik
Geçirgenlik, numuneden geçen ışınımın (I t ), numune üzerindeki ışınım olayına (I 0 ) oranıdır; bu, referanstan geçen ışınım miktarına eşittir. Çoğunlukla yüzde olarak ifade edilir ve %0 ile %100 arasında değişebilir. Aşağıdaki formülle ifade edilir: 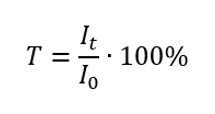 Absorbans ve geçirgenlik arasındaki ilişki şu şekilde ifade edilir:
Absorbans ve geçirgenlik arasındaki ilişki şu şekilde ifade edilir: 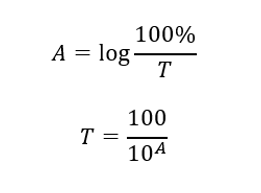
Lambert Yasası
Absorbansın homojen bir numunenin emici katmanının kalınlığı ile orantılı olduğunu söylüyor. Absorbsiyon katsayısının (k) ve ölçülen numune katmanının kalınlığının (l) bölümü olarak kaydedilebilir: 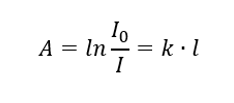

Bira-Lambert yasası
Bu, radyasyonun çözeltiler tarafından emilmesiyle ilgilidir ve aşağıdaki şekilde formüle edilebilir: Eğer çözücünün absorpsiyon katsayısı sıfır ise, o zaman homojen bir çözeltiden geçen monokromatik radyasyon ışınının absorbansı, çözeltinin konsantrasyonu (c) ile doğru orantılıdır. ve emici katmanın (l) kalınlığına kadar. Beer-Lambert yasası absorbansın tanımıdır ve şu şekilde yazılabilir: 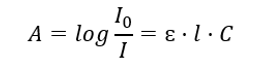 Molar absorpsiyon katsayısı (ɛ), bir maddenin belirli bir çözücüde ve belirli bir dalga boyunda karakteristik bir değeridir. Molekülün enerji seviyeleri arasındaki geçişlerin olasılığı ile orantılıdır ve radyasyon fotonlarının enerjisine doğrudan bağlıdır. Sayısal olarak, 1 mol/ dm3 konsantrasyonuna ve 1 cm emici katman kalınlığına sahip bir çözeltinin sergilediği absorbansı temsil eder. Katsayıyı bilmek, absorbansın büyüklüğünü ölçtükten sonra test çözeltisinin konsantrasyonunu belirlemeyi mümkün kılar. İsteğe bağlı olarak çözeltinin beklenen absorbansı katsayı ve konsantrasyondan da hesaplanabilir. Formül esas olarak bilinen bir molar absorpsiyon katsayısına ve ampirik olarak ölçülen absorbansa sahip bir maddenin konsantrasyonunu belirlemek için kullanılır. Bu, bir formül kullanılarak veya madde için beklenen konsantrasyon aralığındaki birkaç noktada bir kalibrasyon eğrisi çizilerek yapılabilir. Beer-Lambert yasası aynı zamanda emilimin konsantrasyon bağımlılığı olarak da sunulabilir: A = f(C).
Molar absorpsiyon katsayısı (ɛ), bir maddenin belirli bir çözücüde ve belirli bir dalga boyunda karakteristik bir değeridir. Molekülün enerji seviyeleri arasındaki geçişlerin olasılığı ile orantılıdır ve radyasyon fotonlarının enerjisine doğrudan bağlıdır. Sayısal olarak, 1 mol/ dm3 konsantrasyonuna ve 1 cm emici katman kalınlığına sahip bir çözeltinin sergilediği absorbansı temsil eder. Katsayıyı bilmek, absorbansın büyüklüğünü ölçtükten sonra test çözeltisinin konsantrasyonunu belirlemeyi mümkün kılar. İsteğe bağlı olarak çözeltinin beklenen absorbansı katsayı ve konsantrasyondan da hesaplanabilir. Formül esas olarak bilinen bir molar absorpsiyon katsayısına ve ampirik olarak ölçülen absorbansa sahip bir maddenin konsantrasyonunu belirlemek için kullanılır. Bu, bir formül kullanılarak veya madde için beklenen konsantrasyon aralığındaki birkaç noktada bir kalibrasyon eğrisi çizilerek yapılabilir. Beer-Lambert yasası aynı zamanda emilimin konsantrasyon bağımlılığı olarak da sunulabilir: A = f(C).
Toplama kanunu
Beer-Lambert yasası, çözeltide bir emici maddenin bulunduğu durumu ifade eder. Bununla birlikte, çok bileşenli bir çözeltide seçilen bir dalga boyunda radyasyonu emen daha fazla madde varsa, bu çözeltinin (A) absorbansı, bireysel bileşenlerinin ( A1 , A2 ,…) absorbanslarının toplamına eşittir, yani A=A 1 +A 2 +⋯+A n . Her bir bileşenin absorbansının, konsantrasyonunun ve karşılık gelen molar absorbsiyon katsayısının ürünü olduğunu belirtmekte ve hatırlamakta fayda var. Bu, çok bileşenli sistemlerin spektrofotometrik analizinde kullanılan 3. soğurma yasasıdır.
Emilim yasalarından sapmalar
Soğurma yasalarını karşılamanın ön koşulu, sisteme etki eden radyasyonun tek renkli olması ve yoğunluğunun çok yüksek olmamasıdır. Beer-Lambert yasasından sapmanın nedenleri şunlar olabilir:
- Koşulun karşılanmamasına neden olacak şekilde ölçüm cihazlarının kusurlu olması,
- Ölçüm sırasında meydana gelen kimyasal reaksiyonlar, örneğin polimerizasyon , hidroliz, yoğunlaşma,
- çözeltinin bulanıklığı.
Elektron absorpsiyon spektrumlarının uygulanması
- Farklı polaritedeki çözücülerdeki spektrumların incelenmesiyle elektron geçişlerinin tipinin belirlenmesine olanak sağlar.
- Farklı moleküler formların absorpsiyon bantlarının konumu ve yoğunluğundaki farklılıklar, çözelti içinde aralarında kurulan dengeleri ( yapısal çalışmalar , totomerik dengeler) incelemek için kullanılır.
- Beer-Lamber yasasına dayalı bileşik tespiti için kullanılır.
- Test maddelerinin λ maksimum konumuna dayalı ek bir tanımlama yöntemi olarak kullanılır.
- Test bileşiklerinin saflığının belirlenmesinde kullanılır – absorpsiyonun maksimum konumunun kaydırılması, spektrumdaki iki farklı noktadaki absorbans değerlerinin oranının karşılaştırılması.

UV-Vis elektron spektroskopisi
Absorbsiyon olgusu açısından, UV-Vis spektrofotometrisi özellikle ilgi çekici bir tekniktir ve birçok maddenin niteliksel ve niceliksel analizine olanak sağlar. Radyasyon absorpsiyonu olgusu şu durumlarda kullanılır: absorpsiyonun konsantrasyona doğrusal olarak bağlı olması veya absorpsiyonun toplamsal olması, yani çok bileşenli bir çözelti için, bileşenlerinin absorpsiyonlarının toplamı olması durumunda. Sistemde moleküller arası etkileşim olmadığında koşullar karşılanır. Elektromanyetik radyasyonun çözeltiden geçişi sonucu ortaya çıkan UV-Vis absorpsiyon spektrumları analiz edilerek değerlik elektronlarının topraktan uyarılmış duruma geçişleri gözlemlenir. Bu olay, radyasyonun bir kısmının belirli dalga boylarında emilmesiyle sonuçlanır. Soğurma, bu elektronların daha yüksek enerji seviyelerine geçişinin sonucudur, ancak bunun gerçekleşebilmesi için elektromanyetik radyasyon kuantumunun, enerji seviyeleri arasındaki enerji farkını dengeleyecek yeterli enerjiye sahip olması gerekir. Moleküllerde bu tür enerjiler birkaç elektronvolttur ve bu da tam olarak UV-Vis frekansına karşılık gelir.
Kromoforlar
UV-Vis aralığında soğurma gösteren bileşiklerin yapısında kromoforlar, yani elektronları düşük uyarılma enerjileriyle karakterize edilen atom grupları bulunur. Başka bir deyişle kromofor, görünür aralıktaki (180-800 nm) radyasyonun seçici olarak emilmesinden ve dolayısıyla rengin oluşmasından sorumlu olan bir molekülün (atom grubu) parçasıdır. Bunlar şunları içerir: hem karbon atomları arasındaki hem de karbonil grubu C=O gibi diğerleri arasındaki aromatik halkalar (aromatik elektron altılısı), çoklu bağlar (bunların bir kısmı – π tipi bağlar).
Yardımcıkromlar
Diğer bir grup atom ise oksokromlardır, yani UV-Vis aralığında soğurma göstermeyen ikame edicilerdir, ancak bunların varlığı soğurucu elemanların spektrumlarında değişikliklere neden olur. Kromoforların etkisini arttırırlar, bunu sıklıkla test maddesinin sistemde bulunmaması durumunda olduğundan çok daha yoğun bir renklenme şeklinde gözlemleyebiliriz. Ek olarak, oksokromları, emilimi maksimumu daha uzun dalga boylarına doğru kaydıran –NH2 , -OH gibi batokromlara ve maksimumu daha kısa dalga boylarına doğru kaydıran –CH3 , -CO gibi hipsokromlara böleriz.
Atomik Absorbsiyon Spektroskopisi (AAS)
Bu, emilim olgusunu kullanan başka bir tekniktir. Herhangi bir durumdaki (sıvı, katı, gaz) numune formundaki kimyasal elementleri belirlemek için kullanılır ve ölçümün kendisi, belirli bir dalga boyundaki radyasyonun serbest metal atomları tarafından emilmesinin gözlemlenmesine dayanır. Tekniğin temeli, bir atomun yalnızca aynı zamanda onu yayabileceği dalga boyundaki elektromanyetik radyasyonu emebilmesidir ve bu yalnızca belirli bir elementin özelliğidir. Atoma verilen enerji arttıkça elektronlar daha yüksek seviyelere uyarılır ve spektrumda daha fazla sayıda çizgi gözlenir. Sağlanan enerji atomun iyonlaşma potansiyeline karşılık gelirse Na + gibi iyonlar oluşur. Atomik absorpsiyon spektrometresi ile kantitatif analizin temeli, absorbansın soğuran atomların sayısıyla orantılılığı ve Beer-Lambert yasasıdır.
