Stokiyometri, kimyasal reaksiyonların niceliksel seyrine ilişkin hesaplamalarla ilgilenen genel kimyanın dalıdır. Laboratuvarda çalışırken, yürüttüğümüz kimyasal reaksiyonun tam olarak gerçekleşmesi veya ürün miktarının elde edilmesi için ne kadar substrat (kütle, hacim, molekül) kullanmamız gerektiğini bilmek çoğu zaman gereklidir. istiyoruz. Bazen deneyin beklenenden farklı yürütülmesine neden olan fazlalık veya eksik substratın hesaplanması da gerekli olabilir. Bu hesaplamaların her biri doğrudan kimyasal reaksiyon denkleminin niceliksel yorumundan kaynaklanır ve kütlenin korunumu yasalarını kullanır. Bu tür denklemlere stokiyometrik hesaplamalar denir.

Ne bilmemiz gerekiyor?
Stokiyometriyi kullanabilmek için, kimyasal reaksiyon denklemleri, stokiyometrik katsayılar, mol ve molar kütleler ve gazların molar hacimleri ve Avogadro kanunu dahil olmak üzere çeşitli alanlarda bilgi sahibi olmamız gerekir. Kimyasal reaksiyonların stokiyometrisi bilgisini kullanarak aşağıdakiler gibi birçok hesaplama problemi çözülebilir:
- element analizi,
- molar hesaplamalar,
- kütle hesaplamaları,
- reaksiyondaki sınırlayıcı maddenin belirlenmesi imkanı ile stokiyometrik olmayan karışımların hesaplanması,
- reaksiyon verimi.
Molar kütle
Bireysel atom ve moleküllerin akıl almaz derecede küçük kütlesi nedeniyle, atom kütlesini ifade eden (u) birimi yaratıldı. Uygulamada bu, karbon izotopu 12 C’nin kütlesinin 1/12’sine eşit bir değerdir. Bir maddenin bu kısmı , Avogadro sabiti ile yakından ilişkilidir ve 6.022·10 içeren bir maddenin gram sayısı olarak belirlenir. 23 atom, molekül veya iyon. Molar kütle [M] sayısal olarak atom veya moleküler kütleye eşittir ve birimi g/mol’dür.
Maddenin molar hacmi [Vm]
Bu, sıcaklık ve basınç koşullarına büyük ölçüde bağlı olan maddeye özgü bir değerdir. Bu, bir molün kapladığı maddenin hacmidir. Normal koşullar altında 22,4 dm3’lük sabit bir değer benimsenmiştir.
Sabit bileşim kanunu ve kütlenin korunumu
Her kimyasal bileşik, kökenine ve elde edilme yöntemine bakılmaksızın, iyi tanımlanmış ve sabit bir niteliksel ve niceliksel bileşime sahiptir. Örneğin kükürt (IV) oksit her zaman ağırlıkça %50 kükürt ve kükürt (VI) oksit ağırlıkça %40 oranında bu elementi içerir. Kapalı bir sistemde ortaya çıkan ürünlerin kütlesi, reaksiyon sırasında tüketilen substratların kütlesine eşittir. Kütlenin korunumu yasası, her kimyasal reaksiyon denklemini uygun kimyasal katsayılarla dengeleme ihtiyacında yansıtılır, böylece denklemin iki tarafı mevcut atom sayısı açısından eşit olur. Stokiyometrik oranlar, kimyasal reaksiyonda mevcut reaktanların molar oranlarını yansıtır.
Kimyasal reaksiyon denklemi
Kimyasal maddeler arasındaki göreceli ilişkiler hakkında ihtiyaç duyulan tüm bilgiler, kimyasal reaksiyon denklemlerinden elde edilir. Bazı önemli göreceli ve niceliksel bilgiler sağlar.
Örnek 1.
Reaksiyonu takip eden amonyak sentezi denkleminden: ![]() çeşitli yorumlamalar yapabiliriz – moleküler, molar, molar kütleler, molar hacimler ve moleküler sayılar. a) Moleküler olarak, üç molekül hidrojenin bir molekül nitrojenle reaksiyona girerek iki molekül amonyak oluşturduğunu okuyabiliriz. b) Bu aynı zamanda üç mol hidrojenin bir mol nitrojenle reaksiyona girerek iki mol amonyak ürününü oluşturduğu anlamına da gelir. c) Bireysel atomların molar kütlelerini içeren kimyasal elementlerin periyodik tablosunu kullanarak, denklemden 6 g hidrojenin 28 g nitrojenle tamamen reaksiyona girerek 34 g amonyak oluşturduğu sonucunu da çıkarabiliriz. d) O halde normal koşullar altında bir mol gazın 22,4 dm3 kapladığını biliyoruz. Bu, 67,2 dm3 hidrojenin 22,4 dm3 nitrojen ile reaksiyona girerek 44,8 dm3 amonyak oluşturduğu sonucuna varmamızı sağlar. e) Bir diğer yararlı ilişki, aynı basınç ve sıcaklık koşulları altında, farklı gazların eşit hacimlerinin aynı sayıda parçacık içerdiğini belirten Avogadro yasasıdır. Avogadro sabitinin 6,022·10 23 olduğunu bilerek , amonyak sentezine yönelik kimyasal reaksiyonun tamamını gerçekleştirmek için 3·6.022·10 23 hidrojen molekülüne ve 6.022·10 23 nitrojen molekülüne ihtiyacımız olduğunu biliyoruz. Reaksiyon 2·6.022·10 23 amonyak molekülü verir.
çeşitli yorumlamalar yapabiliriz – moleküler, molar, molar kütleler, molar hacimler ve moleküler sayılar. a) Moleküler olarak, üç molekül hidrojenin bir molekül nitrojenle reaksiyona girerek iki molekül amonyak oluşturduğunu okuyabiliriz. b) Bu aynı zamanda üç mol hidrojenin bir mol nitrojenle reaksiyona girerek iki mol amonyak ürününü oluşturduğu anlamına da gelir. c) Bireysel atomların molar kütlelerini içeren kimyasal elementlerin periyodik tablosunu kullanarak, denklemden 6 g hidrojenin 28 g nitrojenle tamamen reaksiyona girerek 34 g amonyak oluşturduğu sonucunu da çıkarabiliriz. d) O halde normal koşullar altında bir mol gazın 22,4 dm3 kapladığını biliyoruz. Bu, 67,2 dm3 hidrojenin 22,4 dm3 nitrojen ile reaksiyona girerek 44,8 dm3 amonyak oluşturduğu sonucuna varmamızı sağlar. e) Bir diğer yararlı ilişki, aynı basınç ve sıcaklık koşulları altında, farklı gazların eşit hacimlerinin aynı sayıda parçacık içerdiğini belirten Avogadro yasasıdır. Avogadro sabitinin 6,022·10 23 olduğunu bilerek , amonyak sentezine yönelik kimyasal reaksiyonun tamamını gerçekleştirmek için 3·6.022·10 23 hidrojen molekülüne ve 6.022·10 23 nitrojen molekülüne ihtiyacımız olduğunu biliyoruz. Reaksiyon 2·6.022·10 23 amonyak molekülü verir.
Örnek 2.
Magnezyumun klordaki yanma reaksiyonu aşağıdaki denkleme göre meydana gelir: ![]() önceki örneğe benzer yorumlar yapmamızı sağlar. a) İlk bakışta bile sunulan denklem, bir molekül magnezyum klorür elde etmek için substrat olarak bir molekül magnezyum ve bir molekül klor sağlamamız gerektiği sonucuna varmamızı sağlar. b) Bu tabii ki sistemdeki mol sayısına eşittir, yani bir mol magnezyum, bir mol klor, bir mol magnezyum klorür. c) Kütle hesaplamaları için 24 g magnezyumun 71 g klor ile reaksiyona girerek 95 g magnezyum klorür oluşturduğunu biliyoruz. d) Söz konusu kimyasal reaksiyonda yalnızca bir gaz, klor yer aldığından, onun için 22,4 dm3 hacim kapladığını da yazabiliriz. e) Partikül sayımlarında her bir bileşen birbirine eşit olup 6.022·10 23 değerini alır.
önceki örneğe benzer yorumlar yapmamızı sağlar. a) İlk bakışta bile sunulan denklem, bir molekül magnezyum klorür elde etmek için substrat olarak bir molekül magnezyum ve bir molekül klor sağlamamız gerektiği sonucuna varmamızı sağlar. b) Bu tabii ki sistemdeki mol sayısına eşittir, yani bir mol magnezyum, bir mol klor, bir mol magnezyum klorür. c) Kütle hesaplamaları için 24 g magnezyumun 71 g klor ile reaksiyona girerek 95 g magnezyum klorür oluşturduğunu biliyoruz. d) Söz konusu kimyasal reaksiyonda yalnızca bir gaz, klor yer aldığından, onun için 22,4 dm3 hacim kapladığını da yazabiliriz. e) Partikül sayımlarında her bir bileşen birbirine eşit olup 6.022·10 23 değerini alır. 
Kimyasal reaksiyonun yüzde verimi [ %W]
Stokiyometrik hesaplamalar aynı zamanda bir reaksiyonun verimini, yani elde edilen gerçek ürün miktarının kimyasal reaksiyon denkleminden elde edilen miktara oranını bulmak için de kullanılır.
Örnek 1.
30 kg sülfür(IV) oksidin oksidasyon reaksiyonu gerçekleştirildi ve bir platin katalizör varlığında elde edilen ürün 34 kg sülfür(VI) oksit oldu. Bu sürecin getirisi ne oldu? Kimyasal reaksiyon denklemi: ![]() Kaydedilen reaksiyondan, iki mol kükürt(IV) oksidin aynı miktarda kükürt(VI) oksit molünü ürettiğini görebiliriz. Reaktiflerin molar kütlelerini bildiğimizde, stokiyometrik olarak, %100 verim varsayarsak, 128 g S02’nin 160 g S03 ürettiğini biliyoruz. Bu bilgiyle oranı ayarlayabiliriz: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 Buradan yüzde 100 oranında üretilecek kükürt(VI) oksit miktarını bulacağız. teslim olmak.
Kaydedilen reaksiyondan, iki mol kükürt(IV) oksidin aynı miktarda kükürt(VI) oksit molünü ürettiğini görebiliriz. Reaktiflerin molar kütlelerini bildiğimizde, stokiyometrik olarak, %100 verim varsayarsak, 128 g S02’nin 160 g S03 ürettiğini biliyoruz. Bu bilgiyle oranı ayarlayabiliriz: 0,128 kg SO 2 – 0,160 kg SO 3 30 kg SO 2 – x kg SO 3 Buradan yüzde 100 oranında üretilecek kükürt(VI) oksit miktarını bulacağız. teslim olmak. 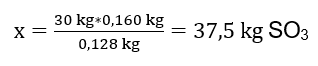 S03’ün teorik ve gerçek miktarını bilerek reaksiyonun meydana geldiği verimi hesaplayabiliriz. 37,5 kg SO3 – %100 verim 34 kg SO3 – %x verim
S03’ün teorik ve gerçek miktarını bilerek reaksiyonun meydana geldiği verimi hesaplayabiliriz. 37,5 kg SO3 – %100 verim 34 kg SO3 – %x verim 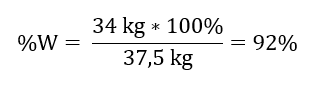 Bir platin katalizör kullanılarak kükürt(IV) oksidin kükürt(VI) okside oksidasyonu %92 verimle gerçekleşti.
Bir platin katalizör kullanılarak kükürt(IV) oksidin kükürt(VI) okside oksidasyonu %92 verimle gerçekleşti.
Moleküler ve elementel formüller
Stokiyometrik hesaplamaların bir diğer uygulaması ise basit kimyasal bileşiklerin formüllerinin belirlenmesidir. Bir kimyasal bileşiğin moleküler formülü ampirik formülle aynıdır veya onun tamsayı katlarıdır. Bir kimyasal bileşiğin genel formülünün N x O y olduğunu biliyorsak, stokiyometrik indekslerin değerleri atom başına kütlenin atom kütlelerine bölünmesiyle hesaplanabilir. Bir kimyasal bileşiğin moleküler ağırlığı bilinmiyor ancak yalnızca yüzde bileşimi biliniyorsa, yalnızca element formülü verilebilir. Moleküler formülün gerçek bir temsili olabilir veya yalnızca bireysel elemanların oranını belirleyebilir.
Örnek 1.
Kimyasal bileşiğin molekül ağırlığı 92 u olup %30,43 nitrojen ve %69,57 oksijenden oluşmaktadır. Kimyasal bileşiğin moleküler formülü nedir? Bileşikte bulunan moleküllerin toplamı %100 olduğundan şunu varsayabiliriz: 92 u – %100 Bu, bireysel element içeriklerini hesaplamamıza olanak tanır: 92 u – %100 xu nitrojen – %30,43 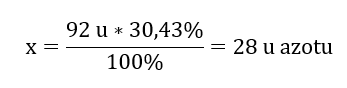 Dolayısıyla oksijen atomu başına kütlenin şöyle olduğunu biliyoruz: 92 u – 28 u = 64 u Elementlerin bireysel kütlelerini bilerek stokiyometrik indeksleri belirleyebiliriz:
Dolayısıyla oksijen atomu başına kütlenin şöyle olduğunu biliyoruz: 92 u – 28 u = 64 u Elementlerin bireysel kütlelerini bilerek stokiyometrik indeksleri belirleyebiliriz: 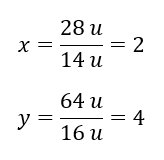 Bu kimyasal bileşiğin moleküler formülü N204’tür .
Bu kimyasal bileşiğin moleküler formülü N204’tür .
Örnek 2.
Kimyasal bileşikte iki element vardır; %60 oksijen ve %40 kükürt. Temel formülü nedir? Genel formül S x O y’dir ; burada x %40 ve y %60’tır. Bireysel elementlerin molar kütleleri bilindiğinde, bu şu şekilde temsil edilebilir: 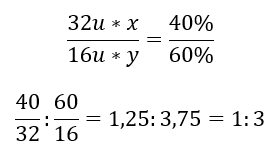 Bu, verilen kimyasal bileşikte her bir kükürt atomuna karşılık üç oksijen atomu bulunduğu anlamına gelir. Element formülü SO3’tür .
Bu, verilen kimyasal bileşikte her bir kükürt atomuna karşılık üç oksijen atomu bulunduğu anlamına gelir. Element formülü SO3’tür . 
Aşırı ve sınırlayıcı alt tabaka
Reaktanların karşılık gelen stokiyometriden farklı oranlarda mevcut olduğu reaksiyonlar durumunda, reaktanlardan biri tamamen reaksiyona girecek ve reaksiyon duracaktır. Bu durumda sınırlayıcı reaktan formunda bulunurken, ikinci reaktan sistemde fazla miktarda bulunacak ve reaksiyon tamamlandığında sistemde hala birincil formunda mevcut olacaktır.
Örnek 1.
Laboratuarda, 40 cm3’lük 0,25 M alüminyum sülfat çözeltisi, 50 cm3’lük 0,5 M baryum klorür çözeltisiyle reaksiyona sokuldu. Kaç gram çökelti oluşacaktır? Kimyasal reaksiyon denklemi: ![]() Bir reaksiyonun gerçek seyrini bilmenin ilk adımı, reaksiyona katılan maddelerin gerçek mol sayısını belirlemektir. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol İkinci adım: reaksiyonun stokiyometrisine dayalı olarak substrat açığını belirlemek için – bu, oluşan çökeltinin miktarını belirleyecektir. 1mol Al2 ( SO4 ) 3 – 3mol BaCl2 0,010 mol Al2 ( SO4 ) 3 – x mol BaCl2
Bir reaksiyonun gerçek seyrini bilmenin ilk adımı, reaksiyona katılan maddelerin gerçek mol sayısını belirlemektir. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 dm 3 = 0,010 mol n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 dm 3 = 0,025 mol İkinci adım: reaksiyonun stokiyometrisine dayalı olarak substrat açığını belirlemek için – bu, oluşan çökeltinin miktarını belirleyecektir. 1mol Al2 ( SO4 ) 3 – 3mol BaCl2 0,010 mol Al2 ( SO4 ) 3 – x mol BaCl2 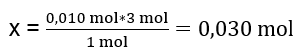 Reaksiyonun tam olarak gerçekleşebilmesi için 0,010mol Al 2 (SO 4 ) 3 içeren sisteme 0,030 mol BaCl 2 eklenmesi gerekmektedir. Ancak yalnızca 0,025 mol baryum klorür reaksiyona girer, bu da baryum klorürün eksik olduğu ve reaksiyonu sınırlayacağı anlamına gelir. Bu nedenle reaksiyonda oluşan çökeltinin miktarı bu substratın miktarından hesaplanmalıdır. Reaksiyonun stokiyometrisine göre kullanılan baryum klorürün mol sayısı, oluşan çökeltinin mol sayısına eşittir, dolayısıyla: n BaSO4 = n BaCl2 0,025mol BaSO 4 = 0,025mol BaCl 2 Baryumun mol sayısını bilme sülfat, kütlesini hesaplayabiliriz: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g Görevde verilen substratların reaksiyonları ve miktarları 5,835 g baryum sülfat çökeltisi üretir.
Reaksiyonun tam olarak gerçekleşebilmesi için 0,010mol Al 2 (SO 4 ) 3 içeren sisteme 0,030 mol BaCl 2 eklenmesi gerekmektedir. Ancak yalnızca 0,025 mol baryum klorür reaksiyona girer, bu da baryum klorürün eksik olduğu ve reaksiyonu sınırlayacağı anlamına gelir. Bu nedenle reaksiyonda oluşan çökeltinin miktarı bu substratın miktarından hesaplanmalıdır. Reaksiyonun stokiyometrisine göre kullanılan baryum klorürün mol sayısı, oluşan çökeltinin mol sayısına eşittir, dolayısıyla: n BaSO4 = n BaCl2 0,025mol BaSO 4 = 0,025mol BaCl 2 Baryumun mol sayısını bilme sülfat, kütlesini hesaplayabiliriz: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025mol · 233,393 g/mol = 5,835g Görevde verilen substratların reaksiyonları ve miktarları 5,835 g baryum sülfat çökeltisi üretir.
