За хімічною будовою алкани належать до групи вуглеводнів. Ці сполуки містять лише два види атомів: вуглець і водень. Вони складаються з основного вуглецевого каркасу, пов’язаного з атомами водню. Алкани мають лише одинарні зв’язки, тому їх називають насиченими вуглеводнями.

Гомологічний ряд
Розташовані за збільшенням кількості атомів водню у своїй структурі, представники алканів утворюють гомологічний ряд. Він починається з метану, що містить один атом вуглецю, і закінчується деканом з дев’ятьма атомами вуглецю. Назви алканів походять від кількості атомів вуглецю, які існують у структурі та визначаються грецькими або латинськими цифрами, а також характерним закінченням -ан, як у гептану, нонану тощо. Загальна формула алканів така: , де «n» позначає кількість вуглецю (C), присутнього в ланцюзі, а «H» позначає атоми водню.
| Кількість атомів вуглецю в ланцюгу | Формула алкану | Назва алкану |
| 1 | CH 4 | Метан |
| 2 | C 2 H 6 | Етан |
| 3 | C 3 H 8 | пропан |
| 4 | C 4 H 10 | Бутан |
| 5 | C 5 H 12 | Пентан |
| 6 | C 6 H 14 | Гексан |
| 7 | C 7 H 16 | Гептан |
| 8 | C 8 H 18 | Октан |
| 9 | C 9 H 20 | Nonane |
| 10 | C 10 H 22 | Декан |
Види насичених вуглеводнів
За будовою ланцюга розрізняють такі типи алканів:
-
Лінійні (парафінові) алкани
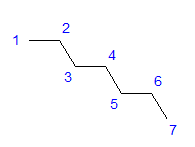 Рис. 1. Структурна формула гептану. Усі атоми вуглецю демонструють гібридизацію sp3 . Завдяки тетрагональному куту між зв’язками потрібне зигзагоподібне розташування атомів вуглецю. Молекули можуть мати різне розташування, оскільки можливе вільне обертання навколо одинарного зв’язку між атомами вуглецю. Чим вище число вуглецю в структурі, тим більш різноманітною може бути форма ланцюга.
Рис. 1. Структурна формула гептану. Усі атоми вуглецю демонструють гібридизацію sp3 . Завдяки тетрагональному куту між зв’язками потрібне зигзагоподібне розташування атомів вуглецю. Молекули можуть мати різне розташування, оскільки можливе вільне обертання навколо одинарного зв’язку між атомами вуглецю. Чим вище число вуглецю в структурі, тим більш різноманітною може бути форма ланцюга.
-
Ізоалкани: розгалужені насичені вуглеводні
Утворення розгалужених вуглеводнів є ефектом зв’язку між атомом вуглецю та більш ніж двома іншими атомами вуглецю. У точці такої ланки утворюється гілка. Розгалужені вуглеводні — лінійні ізомери вуглеводнів. 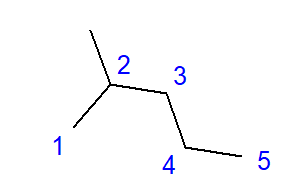 Рис. 2. Структурна формула 2-метилпентану. Формула 2-метилпентану, показана на рис. 2, містить загалом шість атомів вуглецю та є ізомером гексану. Назва «2-метилпентан» означає, що пентановий ланцюг має пов’язану метильну групу в положенні другого атома вуглецю. Кількість можливих структурних ізомерів зростає разом зі збільшенням числа вуглецю. Для прикладу гексан може мати структуру з 5 різних ізомерів, октан має 18 таких можливостей, а гексан аж 75.
Рис. 2. Структурна формула 2-метилпентану. Формула 2-метилпентану, показана на рис. 2, містить загалом шість атомів вуглецю та є ізомером гексану. Назва «2-метилпентан» означає, що пентановий ланцюг має пов’язану метильну групу в положенні другого атома вуглецю. Кількість можливих структурних ізомерів зростає разом зі збільшенням числа вуглецю. Для прикладу гексан може мати структуру з 5 різних ізомерів, октан має 18 таких можливостей, а гексан аж 75.
-
Циклічні вуглеводні: циклоалкани, аліциклічні вуглеводні
Можна замкнути структуру ланцюга, утворюючи кільця, що складаються з повторюваних –CH 2 – елементів. Назви базуються на назві алкану з префіксом «цикло-», наприклад, циклобутан або циклогептан. Для полегшення їх можна представити у вигляді правильних багатокутників. 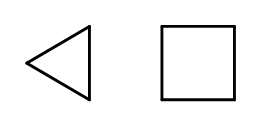 Рис. 3 Ліворуч: циклопропан, циклобутан Є також замісні кільця, назви яких включають замісники. У цьому випадку кількість атомів вуглецю розрахована таким чином, щоб розташування замісників було можливим низьким.
Рис. 3 Ліворуч: циклопропан, циклобутан Є також замісні кільця, назви яких включають замісники. У цьому випадку кількість атомів вуглецю розрахована таким чином, щоб розташування замісників було можливим низьким.
Найважливіші представники
Метан — сполука з молекулярною формулою CH 4 , яка починає гомологічний ряд алканів. Карбон є чотиривалентним, тому він має чотири СН-зв’язки. При кімнатній температурі це газ без запаху і кольору. Оскільки атом вуглецю демонструє гібридизацію sp 3 , він структурований як тетраедр, а утворені орбіталі утворюють еквівалентні зв’язки разом із чотирма атомами водню. Етан — наступний алкан у ряду, молекулярна формула якого C 2 H 6 . Дивлячись на напівструктурну формулу H 3 C-CH 3 , ми помітимо, що кожен атом вуглецю пов’язаний з трьома атомами водню. Як і метан та інші нижчі вуглеводні, це газ без кольору та запаху. Зв’язки CH є фронтальними сигма-sp-s-зв’язками, тоді як одинарний зв’язок між атомами вуглецю є фронтальним сигма-sp-sp-зв’язком.
Синтез алканів
- Гідрогенізація алкенів або алкінів

- Гідроліз сполук Гріньяра
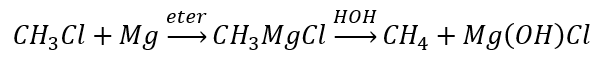
- Відновлення алкілгалогенідів
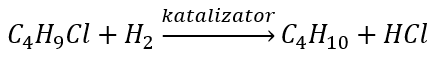
- Реакція Вюрца
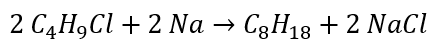
Відновлення альдегідів і кетонів
- Редукція Клемменсена
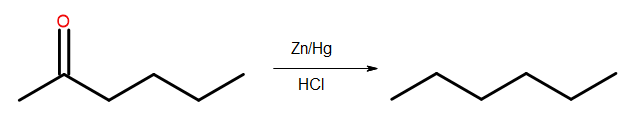 Рис. 4 Діаграма редукції Клемменсена
Рис. 4 Діаграма редукції Клемменсена
- Реакція Вольфа-Кішнера
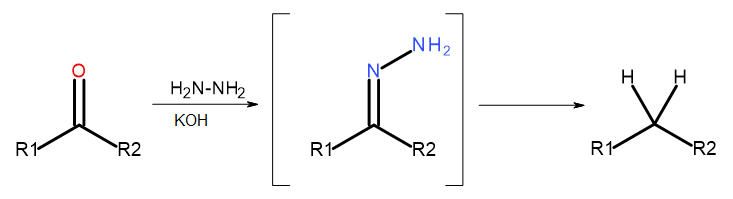 Рис. 5 Діаграма Вольфа-Кішнера
Рис. 5 Діаграма Вольфа-Кішнера
Фізико-хімічні властивості алканів
Коротколанцюгові алкани від С 1 до С 4 при кімнатній температурі є газами. Інші гомологи (починаючи з пентану) є рідинами зі зростаючою температурою кипіння. Розгалуження, присутні в структурі, призводять до нижчої температури кипіння ізомерів. Залежність від додавання іншої –CH 2 – групи в структуру підвищує температуру кипіння приблизно на 20–30 o C разом із збільшенням довжини вуглецевого ланцюга. Агрегатний стан алканів від октадекану до твердого з температурами плавлення, починаючи з 28 o C для n-октадекану. До твердих вуглеводнів відноситься парафін, а до вищих рідких вуглеводнів — парафінове масло. Завдяки своїй гідрофобній природі молекули алканів не змішуються з водою, не змочуються водою і не розчиняються у воді. Однак через свою спорідненість до неполярних характеристик вони легко розчиняються в собі та в подібних неполярних, середньо- та низькополярних органічних розчинниках. Розчинність алканів у двох популярних спиртових розчинниках (метанолі та етанолі) відносно добра. У метанолі алкани добре розчиняються лише до заданої концентрації. Перевищення цієї концентрації призводить до розділення фаз. В етанолі нижчі алкани розчиняються дуже легко, тоді як вищі алкани трохи важче розчинити. Вищі вуглеводні є легкозаймистими речовинами. Газоподібні вуглеводні, а також пари рідких вуглеводнів утворюють при змішуванні з повітрям вибухонебезпечні суміші. Реакційна здатність алканів відносно низька через відсутність потенційно реакційноздатних функціональних груп. Зв’язки між атомами вуглецю (CC), а також зв’язки між атомами вуглецю та кисню (CH) дуже стійкі до розриву. Енергії цих зв’язків дорівнюють відповідно 88 ккал/моль і 104 ккал/моль. Вони можуть різко реагувати лише за певних умов.
Реакції алканів
- Повне згоряння – з виділенням вуглекислого газу
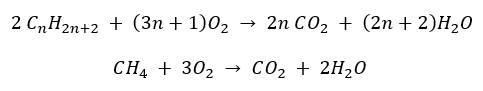
- Напівзгоряння – з обмеженим вмістом кисню та виділенням чадного газу
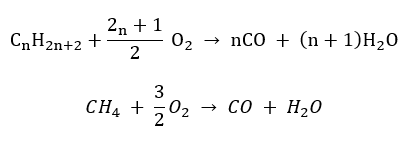
- Неповне згоряння – сажа утворюється з дуже обмеженою кількістю кисню
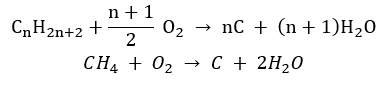
- Реакція заміщення (радикальне галогенування, на прикладі реакції метану з хлором за участю світла)
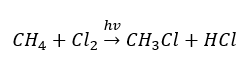
- Піроліз – це розкладання алканів на більш дрібні молекули при дуже високій температурі. Залежно від процесу може відбуватися крекінг, гідрокрекінг або ізомеризація.
- Нітрування з використанням азотної(V) кислоти та утворення суміші продуктів: ізомерів із замісником –NO 2 у різних місцях.
- Двоступеневе сульфування, де мерсоли є проміжними продуктами, а мерсолани є кінцевим продуктом.
