Амінокислоти - це група органічних сполук, структура яких складається з атомів вуглецю, азоту, водню та кисню, а також змінної групи бічного ланцюга. Вони являють собою біфункціональні сполуки, молекули яких містять карбоксильні групи COOH і аміногрупи NH 2 .

Загальна формула амінокислот така: NH 2 – R – COOH Їх назва є скороченою формою терміна «α-амінокарбонова кислота». Коли ми говоримо про різні типи амінокислот, ми часто замінюємо їх систематичні назви звичайними назвами. Наприклад, амінооцтова кислота називається гліцин, 2-амінопропанова кислота називається аланіном, а 2-аміно-3-метилбутанова кислота називається валіном.
Класифікація амінокислот
Основний поділ амінокислот на білкові та небілкові. Перша група включає близько 20 сполук, кожна з яких входить до складу білків і є життєво важливою для організму людини. Ці білки, які також існують як структурні молекули в рослинах і тваринах, відіграють фундаментальну роль, беручи участь у багатьох механізмах, відповідальних за підтримку гомеостазу в організмі людини. Інша класифікація враховує можливість вироблення певної амінокислоти або її необхідне надходження в організм людини разом з їжею.
Екзогенні та ендогенні амінокислоти
Екзогенні амінокислоти – це органічні сполуки, необхідні для підтримки гомеостазу в нашому організмі, але вони не здатні до самостійного виробництва. Ось чому вони повинні постачатися у формі відповідної дієти разом із правильно збалансованими стравами та у формі відповідних добавок. До цієї групи амінокислот входять:
- лізин – противірусна амінокислота, яка підвищує імунітет;
- Метіонін, який контролює вироблення гормону росту;
- треонін, який відповідає за належну підтримку вологості шкіри та правильну роботу нервової системи;
- Лейцин, основна роль якого полягає в контролі рівня секретованого кортизолу та рівня цукру, а також у підтримці загоєння ран;
- Ізолейцин – амінокислота, яка бере участь в процесах метаболізму м’язів, особливо в м’язових тканинах;
- Валін, який сприяє відновленню м’язів і видаленню зайвої жирової тканини;
- Триптофан, попередник серотоніну, який підвищує якість сну, покращує фізичний і психічний стан, контролює апетит;
- Фенілаланін, будучи попередником багатьох гормонів, важливих для людського організму, включаючи тирозин, дофамін, адреналін і норадреналін.
До іншої категорії відносяться ендогенні амінокислоти , які регулярно синтезуються в організмі людини, тому потреба в них постійно покривається на автономній основі. Ця група містить більше амінокислот, до яких відносяться:
- Аланін – амінокислота, відповідальна за перенесення глюкози до еритроцитів і мозку;
- Аспарагінова кислота, яка покращує когнітивні функції і здатність до концентрації;
- Аспарагін, який підтримує багато процесів, таких як навчання, запам’ятовування або поліпшення концентрації;
- Глутамінова кислота, яка підтримує процеси травлення, зменшує відчуття втоми, підтримує пам’ять.
Умовні амінокислоти
Це сполуки, які можуть вироблятися в організмі, але лише за умови доступу до відповідних кількостей їхніх попередників. До умовних амінокислот належать:
- аргінін, який уповільнює старіння, скорочує час загоєння ран, покращує фізичну форму;
- Цистеїн, який є будівельним матеріалом при утворенні глутатіону і є важливим елементом виробництва колагену;
- Глутамін, який підтримує роботу кишечника і виведення непотрібних продуктів метаболізму з організму людини;
- тирозин, який так само, як і цистеїн, бере участь у виробленні колагену, але також необхідний для синтезу меланіну і допомагає підтримувати гомеостаз щитовидної залози;
- Гліцин, амінокислота, здатна лікувати артрит і діабет;
- Орнітин, який здатний знижувати рівень кортизолу, покращувати якість сну, підвищувати ефективність роботи кишечника і травних ферментів;
- пролін, який сприятливо впливає на стан шкіри та покращує її еластичність;
- Серин, орієнтований на процеси, що підтримують імунну систему та функціонування нейронів.
Білкові амінокислоти
Як випливає з назви, до складу білків також входять амінокислоти. Більш конкретно, білки – це різні типи амінокислот, поєднаних одна з одною. Їх двадцять, і під час синтезу вони кодуються так званими кодонами (послідовностями трьох нуклеотидів, що містяться в мРНК, які складають кодуючу одиницю). Кожна з них має дві спільні риси: це альфа- і L-амінокислоти. Це означає, що їх аміногрупа пов’язана з альфа-вуглецем, який безпосередньо прилягає до карбонільної групи. Буква «L» позначає стереоізомер у проекції Фішера, тому амінова група розташована в лівій частині формули. 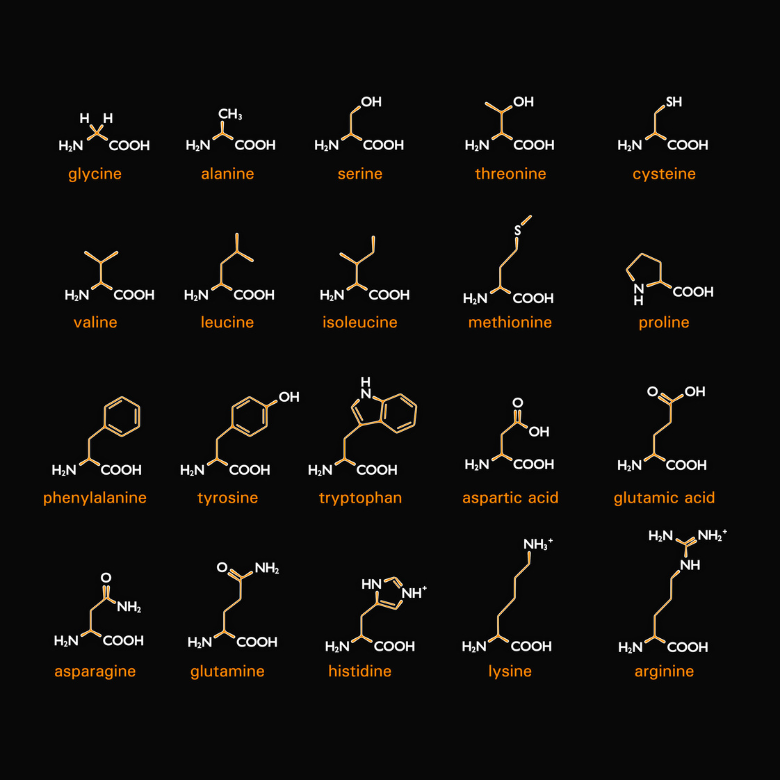
Фізико-хімічні властивості амінокислот
Фізична форма амінокислот зазвичай являє собою кристалічну тверду речовину, що має солодкий смак. Вони добре розчиняються у воді, але вони не розчиняються в органічних розчинниках. Їх температури плавлення відносно високі. Хімічна природа амінокислот амфотерна, а реакція їх водних розчинів нейтральна. Дисоціація утворює подвійні іони, які є результатом нейтралізації основної аміногрупи карбоксильним радикалом. Це призводить до утворення внутрішньої солі амонію, яка має обидва заряди: позитивний і негативний. Їх кількість однакова. Амінокислота може існувати як катіон або аніон, залежно від середовища, в якому вона дисоціює. Для кислих реакцій карбоксильна група не дисоціює, а амінокислота має позитивний заряд. У лужному середовищі реакції зміщуються в бік утворення негативного іона.
Ізоелектрична точка (pI)
Це точка, де амінокислота приймає форму подвійного іона. Для кожної молекули ми можемо налаштувати адекватну концентрацію іонів [H 3 O +], тобто такий рН, коли іони не рухаються в електричному полі. Амфотерна природа амінокислот і їх існування у вигляді подвійних іонів передбачає іонну структуру солей при дії кислот і лугів. Експериментальне визначення ізоелектричної точки проводять додаванням амінокислоти, наприклад казеїну, у відповідні пробірки з розчинами (CH 3 COOH і CH 3 COONa) з відомими концентраціями рН. Ізоелектрична точка досягається там, де відкладення найбільше. Враховуючи характеристику ізоелектричної точки, ми можемо використовувати її для розділення суміші білків за допомогою електрофорезу. Цей метод заснований на кислотно-основних властивостях амінокислот, і суміш поміщають на зволожений папір. Використовуючи відомий рН, ми можемо визначити форму, в якій певні амінокислоти будуть існувати. Тоді, якщо подати на папір напругу, то позитивно заряджені амінокислоти рухатимуться до катода (-), а з негативним зарядом – до анода (+). Нейтрально заряджені сполуки, збалансовані позитивним і негативним зарядами в молекулі, залишаться на тому ж місці.
Реакції, характерні для карбоксильної групи
- Етерифікація, яка полягає в синтезі складних ефірів, отриманих в результаті реакції між амінокислотою та спиртом. Продукт такої реакції не має амфотерної природи, але виявляє властивості використаного аміну.
- Декарбоксилювання, тобто нагрівання амінокислоти в присутності розчину гідроксиду барію (II) (Ba(OH) 2 ). Перетворення утворює аміни.
- Утворення комплексів пов’язане зі здатністю амінокислот зв’язуватися з катіонами металу, головним чином міді, що викликає утворення забарвлених сполук (комплексних солей).

Реакції, характерні для аміногрупи
- Дезамінування, яке стосується амінокислот, які містять первинну аміногрупу. Реакція відбувається під впливом азотної (III) кислоти (HNO 2 ), а амінокислота, яка використовується як реагент, окислюється з утворенням гідрациду. Аміногрупа виділяється у формі азоту. Існує кілька типів дезамінування, включаючи гідролітичне дезамінування, гідролітичне дезамінування з декарбоксилюванням, дезамінування шляхом відновлення та десатураційне дезамінування.
- Окислення, яке змушує амінокислоти перетворюватися на кетокислоти.
- Біохімічні реакції – усі амінокислоти, які можна класифікувати як основи Шиффа, здатні до біохімічних перетворень, таких як пропускання та декарбоксилювання.
Реакції, що використовуються для виявлення амінокислот
- Нінгідринова реакція — це кольорова реакція, де реагентами є амінокислота та реагент у вигляді розчину нінгідрину. Реакція дає характерне фіолетово-синє забарвлення.
- Ксантопротеїнова реакція є прикладом шляху виявлення ароматичних амінокислот, таких як фенілаланін, тирозин або триптофан. Сполука під дією розчину концентрованої азотної (V) кислоти (HNO 3 ) змінює свій колір на жовтий. Це результат утворення похідних нітратної амінокислоти під час реакції.
Джерела амінокислот
Щоб забезпечити хороший фізичний і психічний стан організму людини, ми повинні забезпечити його відповідними кількостями кожного будівельного матеріалу, включаючи амінокислоти. Надзвичайно важливим джерелом усіх амінокислот, необхідних для нормального функціонування, є повноцінні білки. До них входять м’ясо, зокрема птиця, риба, яйця та молочні продукти. Молоко містить велику кількість лейцину, ізолейцину, треоніну та триптофану. Лізин і метіонін містяться в сої. Валін може надходити разом з рисом, арахісом, кунжутом і мигдалем, а фенілаланін, включаючи в свій раціон яйця, сири та злакові продукти. Наявність амінокислот в харчових продуктах є звичним явищем, але щоб наш раціон був правильно збалансованим, продукти, які ми вживаємо, повинні бути різноманітними. Це пояснюється тим, що вони містять лише певні амінокислоти з групи, необхідної для підтримки нормальної життєдіяльності.
