Енергія хімічних реакцій є одним із важливих елементів, які дозволяють зрозуміти перетворення, що відбуваються в хімічній реакції. Під час такого перетворення утворюються хімічні сполуки зі структурою та хімічним складом, відмінними від сировини, з якої вони виготовлені. У ході хімічної реакції зв’язки, що існують між атомами молекул, які використовуються як реагенти, розриваються, і утворюються нові зв’язки, наявні в продуктах.

Система і середовище хімічної реакції
Щоб правильно інтерпретувати хімічну реакцію з точки зору енергії, ми повинні мати деякі знання про наступне:
- Система: відокремлена область матерії з чіткими межами. Важливий тип системи: вона відкрита, якщо реакція включає обмін енергією та речовиною, закрита, якщо реакція включає лише обмін енергією, або ізольована, якщо ні енергія, ні речовина не обмінюються.
- Середовище: все, що не входить до системи, але знаходиться поблизу.
- Компоненти системи: усі речовини, які знаходяться в аналізованій системі та мають характерні хімічні властивості.
Енергія хімічного зв’язку
Енергетичний ефект, який характеризує будь-яку хімічну реакцію, є результатом змін, що відбуваються при розриві та утворенні нових зв’язків між атомами. Справа в тому, що кожен розрив хімічного зв’язку внутрішньо пов’язаний з поглинанням відповідної кількості енергії, тоді як утворення нового зв’язку викликає виробництво енергії. Виділення енергії в навколишнє середовище може мати різні ефекти: тепло, світло, роботу або електрику. Кожен із цих процесів є складовим фактором, що впливає на загальну зміну внутрішньої енергії системи, в якій відбувається реакція. Важливо, що незалежно від того, чи повинні реагенти забирати або віддавати енергію під час перетворення, певна кількість енергії завжди потрібна для початку всього процесу.
Перший закон термодинаміки
Перше важливе правило, що стосується енергії хімічних реакцій, — це співвідношення, сформульоване в першому законі термодинаміки, згідно з яким внутрішня енергія системи, яка тільки обмінюється енергією з навколишнім середовищем (замкнена система), може бути перетворена лише в тепло або роботу. Це відображено в рівнянні Гельмгольца: ∆U = Q + W, де ΔU позначає зміну внутрішньої енергії, Q позначає теплоту, а W позначає роботу. З формули можна помітити, що внутрішня енергія ізольованої системи, тобто такої, яка не обмінюється енергією чи масою з навколишнім середовищем, постійна. Складовими внутрішньої енергії є всі кінетичні енергії атомів, іонів, молекул, електронів і компонентів атомного ядра, які в даний момент знаходяться в реакційній системі, а також енергії їх взаємодії, тобто енергії хімічних зв’язків, взаємодій. між зарядами і так далі. Зверніть увагу, що внутрішня енергія не містить кінетичної або потенційної енергії системи в цілому. Сума кінетичної і потенціальної енергій системи в цілому і внутрішньої енергії є повною енергією системи (E).
Ентальпія системи (H)
Це ще одне важливе поняття, пов’язане з енергією хімічних реакцій, яка на практиці означає суму внутрішньої енергії системи та добуток її тиску та об’єму. У якісному відношенні це енергія, необхідна для створення системи у вакуумі (U), збільшена на роботу, тобто відношення тиску до об’єму (pV), яку система повинна виконати проти зовнішніх сил, щоб досягти об’єму, відмінного від нуль. Співвідношення, що визначає ентальпію системи, виражається таким чином: H = U + pV Реакція, що відбувається в такій системі, викликає нескінченно малу зміну ентальпії: dH = dU + dpV + pdV Якщо умови реакції ізобарні, тож якщо тиск під час процес не змінюється, другу частину можна опустити, оскільки dpV=0. Після заміни диференціалів на певні прирости та після заміни виразу, що стосується зміни внутрішньої енергії системи, ми отримуємо наступне співвідношення: ∆H = Q + W + p∆V Припускаючи, що аналізований процес виконує об’ємну роботу при постійному тиску , то W = -pΔV, а отже: ∆H = Q – p∆V + p∆V З рівняння випливає, що якщо реакція відбувається при постійному тиску, то зміна ентальпії системи дорівнює теплоті: ∆H = Q
Енергетичні можливості реакції
Виходячи з отриманої вище формули, яка вказує на те, що зміна ентальпії системи може дорівнювати теплоті реакції, процеси класифікуються за тепловими перетвореннями. За напрямом потоку енергії хімічні реакції поділяють на:
- Екзотермічні реакції, які є такими реакціями, під час яких ми можемо спостерігати випромінювання енергії, наприклад у вигляді тепла, в навколишнє середовище системи. Це відбувається, коли сума ентальпій продуктів нижча за суму ентальпій субстратів, тому коли ΔH<0.
- Ендотермічні реакції, тобто такі хімічні реакції, які викликають поглинання енергії з навколишнього середовища. Умовою для такої реакції є доставка відповідної кількості цієї енергії. Це стосується всіх перетворень, для яких загальна ентальпія продуктів вища за загальну ентальпію субстратів, тому ΔH>0.
Позначення хімічних реакцій
Розглядаючи хімічні реакції разом із їх потребою в енергії та розподілом, їхні питомі теплові ефекти включені в позначення хімічного рівняння. Для екзотермічних реакцій абсолютне значення наявного теплового ефекту зазначається на стороні продукту. І навпаки, записуючи ендотермічну реакцію, абсолютне значення поглиненої енергії зазначають на стороні субстрату. Наведу приклад:
- Екзотермічна реакція:
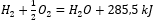
- Ендотермічна реакція: 2H 3 PO 4 + 3Mg(OH) 2 + 407 кДж = Mg 3 (PO 4 ) 2 + 6H 2 O
Інший спосіб — записати хімічне рівняння разом із значенням енергетичного ефекту, відведеним убік. У цьому випадку величина, що представляє енергію екзоенергетичної реакції, є негативною, тоді як для ендоенергетичної реакції вона позитивна. Наприклад:
- Екзоенергетична реакція: Fe + S → FeS ∆H= -95,2 кДж/моль
- Ендоенергетична реакція: FeS → Fe + S ∆H= 95,2 кДж/моль
Закон Гесса
Він є основою для термохімічних розрахунків, стверджуючи, що тепловий ефект завжди однаковий незалежно від способу проведення реакції. Це дозволяє розрахувати стандартну ентальпію реакції (Δ r H ϴ ), припускаючи використання стандартних умов, тобто тиску 10 5 Па та будь-якої температури. Оскільки ентальпія є функцією стану, її мінливість залежить лише від двох величин: у початковому та кінцевому станах, які в хімічній реакції представляють стан субстратів і стан продуктів відповідно. Закон Гесса виражається рівнянням, яке містить стехіометричні коефіцієнти (v) і стандартні молярні ентальпії утворення (Δ f H ϴ ): 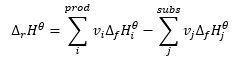
Стандартна молярна ентальпія утворення
Це ентальпія, отримана шляхом утворення 1 моль певної хімічної сполуки з елементів у їх основних станах. Базовий стан – це найбільш витривалий варіант елемента в конкретних умовах. Наприклад, графіт є найбільш міцним варіантом вуглецю при 25 o C і 10 5 Па. І навпаки, при високій температурі і тиску стабільною формою вуглецю є алмаз. Для кожного реагенту, який бере участь у реакції в основному стані, значення стандартної молярної ентальпії утворення дорівнює нулю. Зазвичай це окремі атоми благородних газів або найбільш стійкі в конкретних умовах варіанти інших газів. Для стандартного тиску (10 5 Па) і температури (зазвичай 25 o C) значення стандартних молярних ентальпій утворення сполук зібрані в хімічні таблиці. Одиницею цього значення є . Закон Гесса, застосований до хімічних реакцій, означає, що значення ентальпії реакції не залежить від кількості проміжних реакцій. Єдина ключова інформація полягає в тому, що для отримання певних продуктів використовуються певні субстрати.
Синтез вуглекислого газу
Синтез вуглекислого газу може здійснюватися різними способами, але згідно із законом Гесса кожен з них призводить до однакової величини зміни стандартних ентальпій.
- Прямий синтез
- Синтез карбон (II) оксиду + окислення сполуки до карбон (IV) оксиду
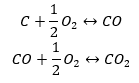 Коли ми зчитаємо з таблиці значення стандартних ентальпій утворення сполук і підставимо їх у хімічні рівняння, то побачимо, що ентальпія для кожного методу однакова: -393,5 кДж/моль.
Коли ми зчитаємо з таблиці значення стандартних ентальпій утворення сполук і підставимо їх у хімічні рівняння, то побачимо, що ентальпія для кожного методу однакова: -393,5 кДж/моль.
Закон Кірхгофа
Це дозволяє нам трансформувати обчислення, щоб обчислити стандартну ентальпію реакції для певної температури, якщо ми знаємо її значення за іншої температури. Ми також знаємо співвідношення між молярною теплотою всіх реагентів і температурою. Закон можна застосувати, оскільки зміна ентальпії реакції залежить від умов, у яких вона була визначена: вона змінюється разом зі зміною температури і тиску. Виведення формули слід почати з визначення теплової потужності, тобто відношення підведеної теплоти до підвищення температури: ![]() Припускаючи ізотермічні умови, можна зробити таке перетворення:
Припускаючи ізотермічні умови, можна зробити таке перетворення: ![]() Інтегрування отриманого рівняння та перетворення теплової потужності в частину, що представляє зміну стандартної теплоємності, відображається рівнянням, що забезпечується законом Кірхгофа:
Інтегрування отриманого рівняння та перетворення теплової потужності в частину, що представляє зміну стандартної теплоємності, відображається рівнянням, що забезпечується законом Кірхгофа: 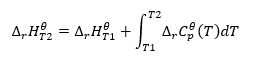 Для стандартних умов зміна теплоємності реакції визначається рівнянням з v-змінними, які є стехіометричними факторами, і , що представляє стандартну молярну теплоту даного реагенту. Коли різниця температур невелика (до 100 К), значення стандартної молярної теплоти реагенту вважається постійним у певному діапазоні. Тоді ми можемо використати спрощену форму закону Кірхгофа, припускаючи, що теплоємність реагентів залежить не від температури, а від постійного тиску:
Для стандартних умов зміна теплоємності реакції визначається рівнянням з v-змінними, які є стехіометричними факторами, і , що представляє стандартну молярну теплоту даного реагенту. Коли різниця температур невелика (до 100 К), значення стандартної молярної теплоти реагенту вважається постійним у певному діапазоні. Тоді ми можемо використати спрощену форму закону Кірхгофа, припускаючи, що теплоємність реагентів залежить не від температури, а від постійного тиску: ![]()
