Дивлячись на їх структуру, карбонові кислоти є важливими органічними сполуками, і вони є ацильними похідними. Вони є своєрідними будівельними матеріалами для багатьох похідних, включаючи складні ефіри та аміди. У природі ми можемо знайти цілий ряд різноманітних карбонових кислот, таких як оцтова кислота CH 3 COOH, яка є основною сполукою столового оцту, масляна кислота CH 3 CH 2 CH 2 COOH, відповідальна за запах згірклого масла, тощо. складна холєва кислота, яка є основним компонентом жовчних соків людини.

Загальна формула карбонових кислот:
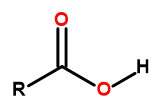
Рисунок 1. Загальна формула карбонових кислот:
Номенклатура карбонових кислот
Відповідно до системи номенклатури IUPAC, карбонові кислоти можна назвати двома способами, залежно від розміру та складності молекули. Кислоти, які є аліфатичними похідними, систематично називають шляхом зміни закінчення алкану з -ан на -оєву та додавання початкового слова «кислота», наприклад, пропанова кислота, бутанова кислота, 3-етил-6-метилоктандіова кислота. Нумерація атомів вуглецю в таких хімічних сполуках завжди починається з атома функціональної групи –СООН. Друга система іменування, особливо корисна для кислот, у яких карбоксильна група приєднана до кільця, дозволяє додавати слова «кислота» перед і «карбоксильна» після нього до систематичної назви сполуки. У таких випадках нумерація атомів вуглецю починається з атома, до якого приєднана карбоксильна група, яка сама розглядається як заступник.
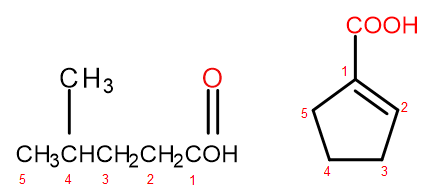
Малюнок 2 Нумерація атомів вуглецю, зліва направо: 4-метилпентанова кислота, 1-циклопентенкарбонова кислота.
| Карбонова кислота | Ацильна група | ||
| Структура | Ім’я | Структура | Ім’я |
| HCOOH | Мурашина | HCO- | форміл- |
| CH 3 COOH | Оцтова | CH 3 CO- | ацетил- |
| CH 3 CH 2 CH 2 COOH | Маслянокислий | CH 3 CH 2 CH 2 CO- | Бутирил- |
| ООООООО | Щавлевий | -ОККО- | оксаліл- |
| HOOC(CH 2 ) 2 COOH | Бурштиновий | -OC(CH 2 ) 2 CO- | сукциніл- |
Будова та фізичні властивості карбонових кислот
Подібність карбоксильної групи до кетонів і спиртів може свідчити про подібні фізичні властивості. Як і в кетонах, атом вуглецю функціональної групи має sp 2 гібридизацію. Це безпосередньо пов’язано з його плоскою структурою та кутами приблизно 120 ° між зв’язками CCO та OCO. Наприклад, оцтова кислота CH 3 COOH має валентні кути:
- 119 o для CC=O,
- 119 o для CC-OH,
- 122 o для O=C-OH.
Довжина зв’язку наступна:
- 52Å для CC,
- 25Å для C=O,
- 31Å для C-OH.
Карбонові кислоти виявляють свою схожість зі спиртами через їхню сильну асоціативність, спричинену можливістю утворення водневих зв’язків. На практиці більшість цих сполук існують у вигляді циклічних димерів, структура яких підтримується утворенням водневих зв’язків. Така специфічна система водневих зв’язків також впливає на температури кипіння карбонових кислот. Це зумовлює їх значне збільшення порівняно з відповідними спиртами. Наприклад, фізичні константи – температура плавлення і температура кипіння в градусах Цельсія відповідно:
- Мурашина кислота : 8,4; 100,7,
- Оцтова кислота: 16,6; 117,9,
- Пропанова кислота: -20,8; 141,
- Бензойна кислота: 122,1; 249.
Дисоціація карбонових кислот
Кислотні властивості цієї групи сполук дозволяють їм реагувати з основами, включаючи гідроксид натрію та бікарбонат калію. Продуктами таких реакцій є солі карбонових кислот. Розчинність карбонових кислот у воді незначна, але їх солі з лужними металами завдяки своїй іонній будові дуже добре розчиняються у воді. Ці сполуки, які в теорії Бренстеда-Лоурі є кислотами, дисоціюють у розбавлених водних розчинах. У результаті перетворення утворюються карбоксилат-аніон RCOO – і катіон гідроній Н 3 О + .
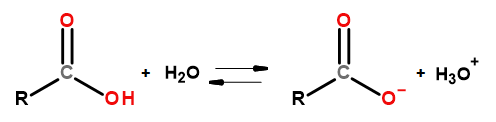
Рисунок 3. Схема дисоціації карбонової кислоти.
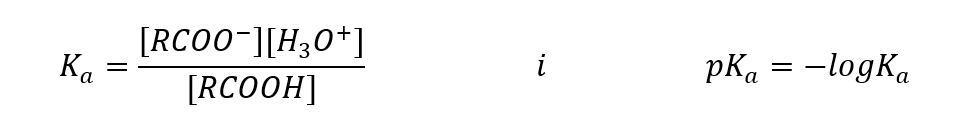 Емпірично визначені значення для карбонових кислот показують, що вони є слабодисоційованими сполуками, тому на практиці вони також є слабкими кислотами. Для більшості з них константа K a приймає значення приблизно 10 -5 . Для оцтової кислоти K a = 1,76·10 -5 , що після перетворення дає значення pK, що дорівнює 4,75. Це дорівнює дисоціації лише приблизно 0,1%молекул, що в порівнянні з сильними неорганічними кислотами зі ступенем дисоціації 100%підтверджує, що це кислоти низької міцності. Порівняно зі спиртами, константи рівноваги яких коливаються в порядку 10-16 , карбонові кислоти набагато сильніші. Незважаючи на їх структурну подібність, цей факт зумовлений стабільністю карбоксилат-аніону відносно алкоксид-аніону. Зауважте, що негативний заряд в алкоксидах припадає на один атом кисню, який є електронегативним. Навпаки, в карбоксилат-аніонах заряд делокалізований між двома атомами кисню функціональної групи. Це робить його більш стабільним порівняно з аніоном, який виробляють спирти.
Емпірично визначені значення для карбонових кислот показують, що вони є слабодисоційованими сполуками, тому на практиці вони також є слабкими кислотами. Для більшості з них константа K a приймає значення приблизно 10 -5 . Для оцтової кислоти K a = 1,76·10 -5 , що після перетворення дає значення pK, що дорівнює 4,75. Це дорівнює дисоціації лише приблизно 0,1%молекул, що в порівнянні з сильними неорганічними кислотами зі ступенем дисоціації 100%підтверджує, що це кислоти низької міцності. Порівняно зі спиртами, константи рівноваги яких коливаються в порядку 10-16 , карбонові кислоти набагато сильніші. Незважаючи на їх структурну подібність, цей факт зумовлений стабільністю карбоксилат-аніону відносно алкоксид-аніону. Зауважте, що негативний заряд в алкоксидах припадає на один атом кисню, який є електронегативним. Навпаки, в карбоксилат-аніонах заряд делокалізований між двома атомами кисню функціональної групи. Це робить його більш стабільним порівняно з аніоном, який виробляють спирти.
Отримання карбонових кислот
- Окислення заміщених алкілбензолів KMnO 4 або Na 2 Cr 2 O 7 з утворенням продукту у вигляді заміщених бензойних кислот. Можливе окислення первинних і вторинних алкільних груп,
- Окислення зв’язку C=C в алкенах з принаймні одним вініловим атомом водню за допомогою KMnO 4 ,
- Окиснення первинних спиртів і альдегідів. Спирти з використанням реактиву Джонса, альдегіди з використанням того самого реактиву та основний оксид срібла,
- Гідроліз нітрилів під дією сильних, гарячих розчинів кислот або основ,
- Реакція сполук Гріньяра з вуглекислим газом, з проміжним продуктом у вигляді карбоксилату магнію. Потім перехідна сполука реагує з кислотою.
Реакції карбонових кислот
Завдяки своїй структурі карбонові кислоти, крім характерних для них реакцій, також зазнають перетворень, подібних до спиртів і кетонів. Як і спирти, вони можуть дисоціювати протон з утворенням нуклеофільного реагенту. Як і кетони, вони піддаються атакам інших нуклеофілів на атом вуглецю карбонільної групи. Крім того, можливе їх відновлення, заміщення в альфа-положенні, нуклеофільне заміщення ацильної групи та депротонування (дисоціація). Відновлення карбонових кислот відбувається за допомогою LiAlH 4 , утворюючи продукт як первинний спирт. Іноді для підвищення ефективності необхідно застосувати нагрівання в розчині тетрагідрофурану. Інший спосіб – відновлення за допомогою борану в розчині тетрагідрофурану, також з отриманням 1 o спиртів.
