Це один з найдавніших інструментальних методів, що використовуються в хімічному аналізі. Його основи були закладені Л. Гальвані, К. А. Вольта, Дж. В. Гіббсом і В. Нернстом між 18 і 19 століттями . Вимірювання, що виконуються за допомогою потенціометричних методів, використовують електрорушійну силу (ЕРС) комірки, побудованої з двох електродів, занурених у досліджуваний розчин. Величина цієї сили безпосередньо залежить від потенціалів використовуваних електродів. Вони, у свою чергу, залежать від активності іонів, що містяться в розчині електроліту, і від природи електродних процесів.
Діаграма електродних процесів на прикладі комірки Даніеля
Комірка Даніеля складається з двох напівкомірок, кожна з яких складається з металу, зануреного в розчин власної солі. Компонентами напівкомірок є системи Cu (s) /Cu 2+ (aq) і Zn (s) /Zn 2+ (aq) . У кожному з них відбувається одна з наступних окисно-відновних реакцій:
- скорочення
Cu 2+ (aq) + 2e – → Cu (s)
- окислення
Zn (s) → Zn 2+ (aq) + 2e – Коли ми поєднуємо обидві реакції, ми отримуємо повне рівняння реакції, що відбувається в клітині: Zn (s) + Cu 2+ (aq) + 2e – → Zn 2 + (aq) + 2e – + Cu (s) Щоб виміряти певну електрорушійну силу елемента, ми повинні з’єднати напівелементи за допомогою соляного містка та під’єднати електроди до вольтметра . Таким чином, ми можемо виміряти різницю потенціалів між окремими електродами, яка представляє значення ЕРС клітини . Відповідно до конвенції IUPAC, діаграма комірки Даніеля виглядає наступним чином: ϴ Zn|Zn 2+ ||Cu 2+ |Cu ⊕ Одинарні лінії позначають поверхню розділу, а подвійні — сольовий місток. Потенціал на межі розділу є результатом реакцій окислення та відновлення. Для клітин ми припускаємо, що електрод, де відбувається окислення, є анодом зі знаком ϴ, тоді як інший є позитивним катодом, де відбувається відновлення . Позначення починається з анода, а катод відзначається праворуч . Електрорушійну силу такого елемента можна розрахувати за такою формулою: ЕРС = потенціал катода – потенціал анода
Стандартний потенціал електрода
Цей термін введено для систематизації, і визначений потенціал електрода вважається «стандартним», якщо він задовольняє декілька умов. Вимірювання проводити при 298 К, активність активних іонів повинна дорівнювати 1 моль/дм 3 , а електродом порівняння повинен бути стандартний водневий електрод, оскільки передбачається, що потенціал цього електрода становить 0,0000 В.
Електрорушійна сила клітини
Значення ЕРС змінюється разом із зміною активності іонів, присутніх у клітині. Рівняння, яке відображає цю залежність, називається рівнянням Нернста : 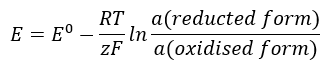 Він використовує такі символи: електродний потенціал (E), стандартний електродний потенціал (E 0 ), газова стала (R), що дорівнює 8,312 Дж/К·моль, температура (T), кількість електронів, що беруть участь в електрохімічній реакції електронів. (z), стала Фарадея (F), що дорівнює 9,64853·10 4 Кл/моль, і активність іонів у відновленій і окисленій формах. Для твердих речовин активність (а) приймається рівною 1.
Він використовує такі символи: електродний потенціал (E), стандартний електродний потенціал (E 0 ), газова стала (R), що дорівнює 8,312 Дж/К·моль, температура (T), кількість електронів, що беруть участь в електрохімічній реакції електронів. (z), стала Фарадея (F), що дорівнює 9,64853·10 4 Кл/моль, і активність іонів у відновленій і окисленій формах. Для твердих речовин активність (а) приймається рівною 1. 
Потенціометричні прилади
Базовий набір для потенціометричних вимірювань складається з двох компонентів: пари електродів, занурених у досліджуваний розчин, і вимірювального пристрою . Першим компонентом є вимірювальна комірка , а другий дозволяє фактично вимірювати його електрорушійну силу. Найважливішою частиною клітини є електроди. За механізмом дії їх можна розділити на чотири групи.
Соляний міст
Важливим елементом будь-якої клітини є сольовий місток, який дозволяє електроду порівняння контактувати з досліджуваним розчином . Основною характеристикою клітини з переносом є контакт між електролітами різної концентрації та складу. Щоб уникнути змішування електроліту моста з досліджуваним розчином, використовуються малі контактні поверхні.
Електроди першого роду
Ці електроди виготовлені з металу або газу, зануреного в розчин, що містить власні іони . Їх також називають електродами, оборотними до катіону , оскільки на їх поверхні відбувається оборотна реакція: M 0 ↔ M n+ + ne. Прикладом електродів першого роду є водневий електрод.
Електроди другого роду
Такі електроди побудовані з металу, покритого його важкорозчинною сіллю . Система занурена у вільнорозчинну сіль, яка містить той самий аніон, що й важкорозчинна сіль. Ці електроди називають електродами, оборотними до загального аніону , оскільки на їх поверхні відбувається наступна реакція: M 0 + A – ↔ MA + e. Приклади електродів другого типу включають срібно-хлоридні або каломельні електроди.
Електроди третього роду
Вони складаються з металів, оточених двома шарами: перший тонкий шар складається з важкорозчинної солі цього металу, а другий шар складається з трохи краще розчинної солі, яка містить той самий аніон. Вони є електродами, оборотними до звичайного катіону , оскільки на їх поверхні відбувається така реакція: M 0 (a) + M (b) A ↔ M (a) A + M + (b) + e 
Окисно-відновні електроди
Структура таких електродів характеризується використанням хімічно інертного металу, наприклад платини або золота, який занурюють у розчин, що містить речовину як у відновленій, так і в окисленій формах . Прикладом таких електродів є хінгідроновий електрод.
Функції електродів у системі
З точки зору застосування в аналітичній системі ми розрізняємо:
- електроди порівняння , які підтримують постійний потенціал незалежно від умов вимірювання або концентрації досліджуваного розчину.
- індикаторні електроди , потенціал яких змінюється, якщо досліджуваний розчин містить іони, до яких вони чутливі.
Електроди порівняння
Потенціометричне вимірювання засноване на порівнянні потенціалу індикаторного електрода з електродом порівняння . З цієї причини такі електроди повинні характеризуватися:
- стабільний потенціал,
- відтворюваний потенціал і температурна незалежність,
- універсальність і зручність використання,
- низький електричний опір,
- відтворюваний і низький потенціал дифузії,
- невеликий потік електроліту електрода в досліджуваний розчин.
Зазвичай використовуваним електродом порівняння є хлоридно-срібний електрод (Ag/AgCl/KCl), який реагує на присутність іонів хлориду. Він побудований зі срібного дроту, покритого шаром хлориду срібла. Іншим прикладом є каломельний електрод (Pt/Hg/Hg 2 Cl 2 /KCl), потенціал якого також залежить від активності в розчині хлорид-іонів.
Індикаторні електроди
Для електродів цієї категорії їх потенціал змінюється при наявності досліджуваних іонів у розчині . Це означає, що їх потенціал безпосередньо залежить від активності, а також від концентрації розчину, в який вони поміщені . Найбільш часто використовуються електроди, занурені в розчини власних іонів, наприклад срібні, ртутні або водневі електроди. Проте в сучасній потенціометрії використовуються іоноселективні мембранні електроди. Вони мають деякі спільні характеристики, наприклад, їх активною частиною є мембрана, а іонна реакція між іонами з розчину та мембраною визначає різницю потенціалів на їх межі. За структурою такі електроди можна розділити на скляні, твердо мембранні, рідко мембранні та подвійні мембранні електроди. Найчастіше використовуються скляні електроди, які складаються зі скляної трубки, закінченої тонкостінною колбою з електродного скла. Він вміщує внутрішній електрод із хлориду срібла, занурений у внутрішній розчин із постійною активністю іонів.
