Спектроскопічні методи — це група методів, у яких сигнал створюється шляхом взаємодії електромагнітного або корпускулярного випромінювання з досліджуваним зразком. Це випромінювання може виникати в результаті періодичних змін електромагнітного поля, пов'язаних з передачею енергії. Ці методи використовуються для визначення концентрації або вмісту атомів у даній системі, що поглинає або випускає. Які бувають види спектрофотометрії і що включають ці методи? Про це ви дізнаєтеся з нашої статті.

Випромінювання та переходи енергії
Найважливішою властивістю фотонів, або квантів випромінювання, є енергія. Формула значення енергії (E) є добутком постійної Планка (h) 6,626·10 -34 [J ·s] і частоти випромінювання (v), вираженої в герцах [Hz]. 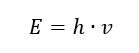 Спектрофотометрія використовує енергетичні переходи в молекулах, викликані поглинанням або випусканням електромагнітного випромінювання в різних діапазонах:
Спектрофотометрія використовує енергетичні переходи в молекулах, викликані поглинанням або випусканням електромагнітного випромінювання в різних діапазонах:
- ультрафіолет (УФ) 200-380 нм,
- видиме випромінювання (Vis) 380-780 нм,
- ближній інфрачервоний (ІЧ) 0,78-30000 мкм.
Основні поняття та закони спектрофотометрії
Ізобестична точка
Це точка, що відповідає певній довжині хвилі, що виникає в результаті перетину кривих, побудованих у системі поглинання-довжини хвилі, де обидві форми сполуки в розчині (дисоційована та недисоційована) мають однакове поглинання. Зміна рН не змінює положення, сполука може мати багато таких точок.
Спектр поглинання хімічної сполуки
Спектр є мірою кількості світла, поглиненого сполукою від довжини світлової хвилі (λ). Якщо електромагнітне випромінювання (світло) з інтенсивністю I 0 падає на зразок, частина цього випромінювання буде поглинена, а частина пройде через зразок. Реєструючи інтенсивність падаючого (I 0 ) і пропущеного (I t ) випромінювання, ми можемо визначити кількість світла, яке поглинається розчином (поглинальна здатність, А) або проходить через нього (коефіцієнт пропускання, Т).
абсорбція
Величина, яка описує явище поглинання, – це поглинання. Це безрозмірна міра інтенсивності електромагнітного випромінювання відносно кількості вільних атомів. Ця цифра була введена для полегшення розрахунків, пов’язаних з обсягами поглинання. Поглинання — це взаємодія між електромагнітним випромінюванням і речовиною — поглинання речовиною частини енергії. Поглинання є адитивним, і його іноді називають оптичною густиною. Символічно це записується як Abs або A. Математично це десятковий логарифм відношення інтенсивності пучка випромінювання, що падає на досліджуваний зразок (I 0 ), до інтенсивності пучка випромінювання, що пройшов через тестовий зразок. (I t ). Він може приймати значення від 0 до нескінченності. Математичний вираз, що описує цю залежність, називається законом Бір-Ламберта. Поглинання на даній довжині хвилі залежить від коефіцієнта поглинання (ε), товщини поглинаючого шару (зазвичай 1 см) і концентрації досліджуваного розчину.
пропускання
Коефіцієнт пропускання – це відношення опромінення, що проходить через зразок (I t ), до опромінення, що падає на зразок (I 0 ), яке дорівнює опроміненню, що проходить через еталон. Найчастіше він виражається у відсотках і може коливатися від 0%до 100%. Вона виражається формулою: 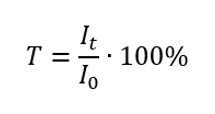 Зв’язок між поглинанням і пропусканням виражається наступним чином:
Зв’язок між поглинанням і пропусканням виражається наступним чином: 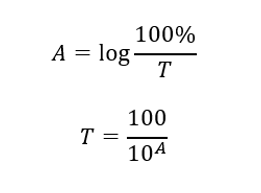
Закон Ламберта
Там сказано, що поглинання пропорційне товщині поглинаючого шару однорідного зразка. Його можна записати як частку коефіцієнта поглинання (k) і товщини виміряного шару зразка (l): 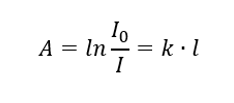

Закон Беера-Ламберта
Він стосується поглинання випромінювання розчинами і може бути сформульований так: якщо коефіцієнт поглинання розчинника дорівнює нулю, то поглинання пучка монохроматичного випромінювання, що проходить через однорідний розчин, прямо пропорційно концентрації (с) розчину і до товщини поглинаючого шару (l). Закон Бір-Ламберта є визначенням поглинання, і його можна записати так: 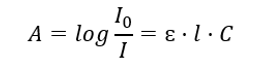 Молярний коефіцієнт поглинання (ɛ) — це характерне значення речовини в певному розчиннику та на певній довжині хвилі. Вона пропорційна ймовірності переходів між енергетичними рівнями молекули і безпосередньо залежить від енергії фотонів випромінювання. У числовому вираженні це поглинання розчину з концентрацією 1 моль/дм 3 з товщиною поглинаючого шару 1 см. Знання коефіцієнта дає можливість визначити концентрацію досліджуваного розчину після вимірювання величини абсорбції. За бажанням, очікувану абсорбцію розчину також можна розрахувати за коефіцієнтом і концентрацією. Формула в основному використовується для визначення концентрації речовини з відомим молярним коефіцієнтом поглинання та емпірично виміряним поглинанням. Це можна зробити за допомогою формули або накресливши калібрувальну криву для речовини в кількох точках діапазону очікуваної концентрації. Закон Беера-Ламберта також можна представити як концентраційну залежність поглинання: A = f(C).
Молярний коефіцієнт поглинання (ɛ) — це характерне значення речовини в певному розчиннику та на певній довжині хвилі. Вона пропорційна ймовірності переходів між енергетичними рівнями молекули і безпосередньо залежить від енергії фотонів випромінювання. У числовому вираженні це поглинання розчину з концентрацією 1 моль/дм 3 з товщиною поглинаючого шару 1 см. Знання коефіцієнта дає можливість визначити концентрацію досліджуваного розчину після вимірювання величини абсорбції. За бажанням, очікувану абсорбцію розчину також можна розрахувати за коефіцієнтом і концентрацією. Формула в основному використовується для визначення концентрації речовини з відомим молярним коефіцієнтом поглинання та емпірично виміряним поглинанням. Це можна зробити за допомогою формули або накресливши калібрувальну криву для речовини в кількох точках діапазону очікуваної концентрації. Закон Беера-Ламберта також можна представити як концентраційну залежність поглинання: A = f(C).
Закон адитивності
Закон Беера-Ламберта відноситься до випадку, коли в розчині є одна поглинаюча речовина. Але якщо в багатокомпонентному розчині більше речовин, які поглинають випромінювання на обраній довжині хвилі, то поглинання цього розчину (А) дорівнює сумі поглинань окремих його компонентів (А 1 , А 2 ,…), тобто A=A 1 +A 2 +⋯+A n . Варто зауважити та пам’ятати, що поглинання кожного компонента є добутком його концентрації та відповідного молярного коефіцієнта поглинання. Це 3-й закон поглинання, який використовується в спектрофотометричному аналізі багатокомпонентних систем.
Відхилення від законів поглинання
Необхідною умовою виконання законів поглинання є те, що випромінювання, що діє на систему, є монохроматичним і його інтенсивність не надто висока. Причинами відхилення від закону Бір-Ламберта можуть бути:
- недосконалість вимірювальних приладів, що призвело до невиконання умови,
- хімічні реакції, що відбуваються під час вимірювання, наприклад полімеризація , гідроліз, конденсація,
- помутніння розчину.
Застосування електронних спектрів поглинання
- Він дозволяє визначити тип електронних переходів, досліджуючи спектри в розчинниках різної полярності.
- Відмінності в положенні та інтенсивності смуг поглинання різних молекулярних форм використовуються для вивчення рівноваг, що встановлюються між ними в розчині ( структурні дослідження , таутомерні рівноваги).
- Використовується для визначення сполук на основі закону Бір-Ламбера.
- Використовується як додатковий метод ідентифікації на основі положення λ max досліджуваних речовин.
- Використовується при визначенні чистоти досліджуваних сполук – зміщення положення максимуму поглинання, порівняння співвідношення значень поглинання в двох різних точках спектру.

Електронна спектроскопія UV-Vis
З точки зору явища поглинання, спектрофотометрія УФ-видимого діапазону є особливо цікавою технікою, що дозволяє якісно та кількісно аналізувати багато речовин. Явище поглинання випромінювання використовується, коли: поглинання лінійно залежить від концентрації або коли поглинання є адитивним, тобто для багатокомпонентного розчину воно є сумою поглинань його компонентів. Умови виконуються, коли в системі відсутні міжмолекулярні взаємодії. Аналізуючи спектри поглинання UV-Vis, що є результатом проходження електромагнітного випромінювання через розчин, спостерігаються переходи валентних електронів з основного у збуджений стан. Це явище призводить до поглинання частини випромінювання на певних довжинах хвиль. Поглинання є наслідком переходу цих електронів на більш високі енергетичні рівні, але для того, щоб це сталося, кванти електромагнітного випромінювання повинні мати достатню енергію, щоб збалансувати різницю енергій між енергетичними рівнями. У молекулах такі енергії становлять кілька електронвольт, що точно відповідає частоті УФ-Вид.
Хромофори
Сполуки, що виявляють поглинання в УФ-видимому діапазоні, мають у своїй структурі хромофори, тобто групи атомів, електрони яких характеризуються низькою енергією збудження. Іншими словами, хромофор — це частина молекули (групи атомів), яка відповідає за вибіркове поглинання випромінювання у видимому діапазоні (180-800 нм) і, таким чином, за появу кольору. До них відносяться: ароматичні кільця (ароматичний електронний секстет), кратні зв’язки (частина з них – зв’язки π-типу), як між атомами вуглецю, так і інші, наприклад карбонільна група С=О.
Ауксохроми
Інша група атомів – це ауксохроми, тобто замісники, які не виявляють поглинання в УФ-видимому діапазоні, але їх присутність викликає зміни в спектрах поглинаючих елементів. Вони підсилюють дію хромофорів, що часто можна спостерігати у вигляді набагато більш інтенсивного забарвлення досліджуваної речовини, ніж у разі їх відсутності в системі. Крім того, ми поділяємо ауксохроми на батохроми , наприклад –NH 2 , -OH, які зміщують максимум поглинання в бік більших довжин хвиль, і гіпсохроми , такі як –CH 3 , -CO, які зміщують максимум у бік коротших хвиль.
Атомно-абсорбційна спектроскопія (AAS)
Це ще одна техніка, яка використовує явище поглинання. Використовується для визначення хімічних елементів у вигляді зразків у будь-якому стані (рідкий, твердий, газоподібний), а саме вимірювання засноване на спостереженні за поглинанням випромінювання певної довжини хвилі вільними атомами металу. Основа техніки полягає в тому, що атом може поглинати електромагнітне випромінювання тільки на такій довжині хвилі, на якій він може його також випромінювати, і це характерно лише для даного елемента. При вищій енергії, що надходить до атома, електрони збуджуються на вищих рівнях, і в спектрі спостерігається більша кількість ліній. Якщо підведена енергія відповідає потенціалу іонізації атома, утворюються такі іони, як Na + . Основою для кількісного аналізу за допомогою атомно-абсорбційної спектрометрії є пропорційність поглинання кількості поглинаючих атомів і закон Бір-Ламберта.
