Стехіометрія — розділ загальної хімії, який займається обчисленнями кількісного перебігу хімічних реакцій. Працюючи в лабораторії, дуже часто необхідно знати, яку кількість (маса, об’єм, молекули) субстратів нам потрібно використати, щоб хімічна реакція, яку ми проводимо, пройшла повністю або щоб отримати кількість продукту. ми хочемо. Іноді також необхідно обчислити надлишок або брак субстрату, який спричинив проведення експерименту не так, як очікувалося. Кожне з цих розрахунків безпосередньо випливає з кількісної інтерпретації рівняння хімічної реакції та використовує закони збереження маси. Ці типи рівнянь називаються стехіометричними розрахунками.

Що нам потрібно знати?
Щоб використовувати стехіометрію, ми повинні мати знання в ряді областей, зокрема: рівняння хімічних реакцій, стехіометричні коефіцієнти, молярні та молярні маси та молярні об’єми газів і закон Авогадро . Використовуючи знання стехіометрії хімічних реакцій, можна вирішити багато розрахункових задач, наприклад:
- елементний аналіз,
- молярні розрахунки,
- масові розрахунки,
- розрахунок нестехіометричних сумішей з можливістю визначення лімітуючої речовини в реакції,
- вихід реакції.
Молярна маса
Через неймовірно малу масу окремих атомів і молекул була створена одиниця (u) , що виражає атомну масу. На практиці це значення дорівнює 1/12 маси ізотопу вуглецю 12 C. Ця частка речовини тісно пов’язана з константою Авогадро і визначається як кількість грамів речовини, яка містить 6,022·10 23 атоми, молекули або іони. Молярна маса [M] чисельно дорівнює атомній або молекулярній масі , а одиницею є г/моль.
Молярний об’єм речовини [Vm]
Це специфічне для речовини значення, яке сильно залежить від умов температури та тиску. Це об’єм речовини, який займає один її моль. За нормальних умов прийнято постійне значення 22,4 дм 3 .
Закон сталості складу і збереження маси
Кожна хімічна сполука, незалежно від її походження і способу отримання, має чітко визначений і постійний якісний і кількісний склад. Наприклад, оксид сірки (IV) завжди містить 50 мас.%сірки, а оксид сірки (VI) — 40 мас.%цього елемента. У закритій системі маса продуктів, що утворюються, дорівнює масі субстратів , витрачених під час реакції. Закон збереження маси відображається в необхідності збалансувати кожне рівняння хімічної реакції з відповідними хімічними коефіцієнтами, щоб обидві сторони рівняння були рівними за кількістю присутніх атомів. Стехіометричні співвідношення відображають молярні співвідношення реагентів, присутніх у хімічній реакції.
Рівняння хімічної реакції
Усю необхідну інформацію про відносні зв’язки між хімічними речовинами отримують з рівняння їхньої хімічної реакції. Він надає важливу відносну та кількісну інформацію.
Приклад 1.
З рівняння синтезу аміаку , яке випливає з реакції: ![]() ми можемо виконати кілька інтерпретацій – молекулярні, молярні, молярні маси, молярні об’єми та молекулярні числа. а) Молекулярно ми можемо прочитати, що три молекули водню реагують з однією молекулою азоту з утворенням двох молекул аміаку. б) Це також означає, що три молі водню реагують з одним молем азоту, утворюючи два молі аміаку. в) Використовуючи періодичну таблицю хімічних елементів , яка містить молярні маси окремих атомів, ми також можемо зробити висновок з рівняння, що 6 г водню повністю прореагували з 28 г азоту з утворенням 34 г аміаку. г) Тоді, припускаючи нормальні умови, ми знаємо, що один моль газу займає 22,4 дм 3 . Це дозволяє зробити висновок, що 67,2 дм 3 водню реагує з 22,4 дм 3 азоту з утворенням 44,8 дм 3 амоніаку. д) Іншим корисним співвідношенням є закон Авогадро, який стверджує, що однакові об’єми різних газів містять однакову кількість частинок за однакових умов тиску та температури. Знаючи константу Авогадро 6,022·10 23 , ми знаємо, що нам потрібно 3·6,022·10 23 молекул водню та 6,022·10 23 молекул азоту для здійснення повної хімічної реакції для синтезу аміаку. У результаті реакції утворюється 2·6,022·10 23 молекул аміаку.
ми можемо виконати кілька інтерпретацій – молекулярні, молярні, молярні маси, молярні об’єми та молекулярні числа. а) Молекулярно ми можемо прочитати, що три молекули водню реагують з однією молекулою азоту з утворенням двох молекул аміаку. б) Це також означає, що три молі водню реагують з одним молем азоту, утворюючи два молі аміаку. в) Використовуючи періодичну таблицю хімічних елементів , яка містить молярні маси окремих атомів, ми також можемо зробити висновок з рівняння, що 6 г водню повністю прореагували з 28 г азоту з утворенням 34 г аміаку. г) Тоді, припускаючи нормальні умови, ми знаємо, що один моль газу займає 22,4 дм 3 . Це дозволяє зробити висновок, що 67,2 дм 3 водню реагує з 22,4 дм 3 азоту з утворенням 44,8 дм 3 амоніаку. д) Іншим корисним співвідношенням є закон Авогадро, який стверджує, що однакові об’єми різних газів містять однакову кількість частинок за однакових умов тиску та температури. Знаючи константу Авогадро 6,022·10 23 , ми знаємо, що нам потрібно 3·6,022·10 23 молекул водню та 6,022·10 23 молекул азоту для здійснення повної хімічної реакції для синтезу аміаку. У результаті реакції утворюється 2·6,022·10 23 молекул аміаку.
Приклад 2.
Реакція горіння магнію в хлорі відбувається за рівнянням: ![]() дозволяє нам придумати тлумачення, подібні до попереднього прикладу. а) Навіть на перший погляд представлене рівняння дозволяє зробити висновок, що для того, щоб отримати одну молекулу хлориду магнію , ми повинні поставити одну молекулу магнію та одну молекулу хлору як субстрати. b) Звичайно, це еквівалентно кількості молей, присутніх у системі, тобто один моль магнію, один моль хлору, один моль хлориду магнію. в) Для обчислення маси ми знаємо, що 24 г магнію реагують з 71 г хлору з утворенням 95 г магній хлориду. г) Оскільки в розглядуваній хімічній реакції бере участь лише один газ — хлор , то для нього також можна записати, що він займає об’єм 22,4 дм 3 . e) У підрахунку частинок кожен компонент дорівнює іншому і приймає значення 6,022·10 23 .
дозволяє нам придумати тлумачення, подібні до попереднього прикладу. а) Навіть на перший погляд представлене рівняння дозволяє зробити висновок, що для того, щоб отримати одну молекулу хлориду магнію , ми повинні поставити одну молекулу магнію та одну молекулу хлору як субстрати. b) Звичайно, це еквівалентно кількості молей, присутніх у системі, тобто один моль магнію, один моль хлору, один моль хлориду магнію. в) Для обчислення маси ми знаємо, що 24 г магнію реагують з 71 г хлору з утворенням 95 г магній хлориду. г) Оскільки в розглядуваній хімічній реакції бере участь лише один газ — хлор , то для нього також можна записати, що він займає об’єм 22,4 дм 3 . e) У підрахунку частинок кожен компонент дорівнює іншому і приймає значення 6,022·10 23 . 
Відсоток виходу хімічної реакції [ %W]
Стехіометричні розрахунки використовують також для визначення виходу реакції, тобто відношення дійсної кількості отриманого продукту до кількості, виведеної з рівняння хімічної реакції.
Приклад 1.
Провели реакцію окиснення 30 кг сульфур(IV) оксиду і в присутності платинового каталізатора одержали 34 кг сульфур(VI) оксиду. З яким був вихід цього процесу? Рівняння хімічної реакції: ![]() Із записаної реакції ми бачимо, що два молі сульфур(IV) оксиду утворюють однакову кількість молей сульфур(VI) оксиду. Знаючи молярні маси реагентів, ми знаємо, що стехіометрично, припускаючи 100%вихід, 128 г SO 2 дає 160 г SO 3 . Маючи ці знання, ми можемо організувати співвідношення: 0,128 кг SO 2 – 0,160 кг SO 3 30 кг SO 2 – x кг SO 3 Звідси ми знайдемо кількість сульфур(VI) оксиду, який утворився б на 100 відсотків врожайність.
Із записаної реакції ми бачимо, що два молі сульфур(IV) оксиду утворюють однакову кількість молей сульфур(VI) оксиду. Знаючи молярні маси реагентів, ми знаємо, що стехіометрично, припускаючи 100%вихід, 128 г SO 2 дає 160 г SO 3 . Маючи ці знання, ми можемо організувати співвідношення: 0,128 кг SO 2 – 0,160 кг SO 3 30 кг SO 2 – x кг SO 3 Звідси ми знайдемо кількість сульфур(VI) оксиду, який утворився б на 100 відсотків врожайність. 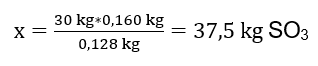 Знаючи теоретичну і фактичну кількість SO 3 , можна розрахувати вихід, з яким відбулася реакція. 37,5 кг SO 3 – 100%вихід 34 кг SO 3 – вихід x%
Знаючи теоретичну і фактичну кількість SO 3 , можна розрахувати вихід, з яким відбулася реакція. 37,5 кг SO 3 – 100%вихід 34 кг SO 3 – вихід x%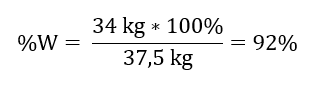 Окиснення сульфур(IV) оксиду до сульфур(VI) оксиду за допомогою платинового каталізатора відбулося з виходом 92%.
Окиснення сульфур(IV) оксиду до сульфур(VI) оксиду за допомогою платинового каталізатора відбулося з виходом 92%.
Молекулярні та елементні формули
Іншим застосуванням стехіометричних розрахунків є визначення формул простих хімічних сполук. Молекулярна формула хімічної сполуки ідентична емпіричній формулі або є цілим числом, кратним їй. Якщо ми знаємо, що загальна формула хімічної сполуки N x O y , значення стехіометричних індексів можна обчислити, поділивши масу атомів на їх атомні маси. Якщо не відома молекулярна маса хімічної сполуки, а відома лише її процентний склад, можна навести лише елементну формулу. Це може бути справжнім відображенням молекулярної формули або просто визначати співвідношення окремих елементів.
Приклад 1.
Молекулярна маса хімічної сполуки становить 92 од., і вона складається з 30,43%азоту та 69,57%кисню. Яка молекулярна формула хімічної сполуки? Оскільки сума молекул, присутніх у з’єднанні, становить 100%, ми можемо припустити, що: 92 u – 100%Це дозволяє розрахувати індивідуальний вміст елементів: 92 u – 100%xu азоту – 30,43%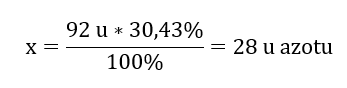 Отже, ми знаємо, що маса атомів кисню становить: 92 u – 28 u = 64 u. Знаючи індивідуальні маси елементів, ми можемо визначити стехіометричні показники:
Отже, ми знаємо, що маса атомів кисню становить: 92 u – 28 u = 64 u. Знаючи індивідуальні маси елементів, ми можемо визначити стехіометричні показники: 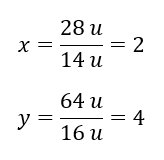 Молекулярна формула цієї хімічної сполуки N 2 O 4 .
Молекулярна формула цієї хімічної сполуки N 2 O 4 .
Приклад 2.
До хімічної сполуки входять два елементи – 60%кисень і 40%сірка. Яка його елементна формула? Загальна формула S x O y , де x дорівнює 40%, а y дорівнює 60%. Знаючи молярні маси окремих елементів, це можна представити так: 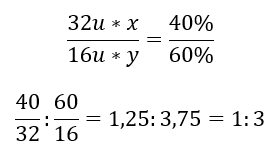 Це означає, що в даній хімічній сполукі на кожен атом сірки припадає три атоми кисню. Елементарна формула SO 3 .
Це означає, що в даній хімічній сполукі на кожен атом сірки припадає три атоми кисню. Елементарна формула SO 3 . 
Надлишковий і обмежуючий субстрат
У разі реакцій, у яких реагенти присутні у співвідношеннях, що відрізняються від відповідної стехіометрії, один із реагентів прореагує повністю, і реакція припиниться. Потім він присутній у формі обмежувального реагенту, тоді як другий реагент буде в системі в надлишку і також буде присутній у системі у своїй первинній формі, коли реакція завершиться.
Приклад 1.
У лабораторії 40 см 3 0,25 М розчину алюміній сульфату прореагували з 50 см 3 0,5 М розчину барій хлориду. Скільки грамів осаду утвориться? Рівняння хімічної реакції: ![]() Першим кроком до визначення фактичного перебігу реакції є визначення фактичної кількості молей речовин, що беруть участь у реакції. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 дм 3 = 0,010 моль n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 дм 3 = 0,025 моль Друга стадія: визначити дефіцит субстрату на основі стехіометрії реакції – це дозволить визначити кількість утвореного осаду. 1 моль Al 2 (SO 4 ) 3 – 3 моль BaCl 2 0,010 моль Al 2 (SO 4 ) 3 – x моль BaCl 2
Першим кроком до визначення фактичного перебігу реакції є визначення фактичної кількості молей речовин, що беруть участь у реакції. n Al2(SO4)2 : C Al2(SO4)2 · V Al2(SO4)2 = 0,25 · 0,04 дм 3 = 0,010 моль n BaCl2 : C BaCl2 · V BaCl2 = 0,5 · 0,05 дм 3 = 0,025 моль Друга стадія: визначити дефіцит субстрату на основі стехіометрії реакції – це дозволить визначити кількість утвореного осаду. 1 моль Al 2 (SO 4 ) 3 – 3 моль BaCl 2 0,010 моль Al 2 (SO 4 ) 3 – x моль BaCl 2 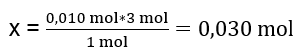 Щоб реакція пройшла повністю, маючи 0,010 моль Al 2 (SO 4 ) 3 , необхідно додати в систему 0,030 моль BaCl 2 . Однак реагує лише 0,025 моль хлориду барію, що означає його дефіцит і обмежить реакцію. Тому кількість осаду, що утворюється в реакції, слід розраховувати за кількістю цього субстрату. Кількість молей хлориду барію, використаного відповідно до стехіометрії реакції, дорівнює кількості молей утвореного осаду, таким чином: n BaSO4 = n BaCl2 0,025 моль BaSO 4 = 0,025 моль BaCl 2 Знаючи кількість молей барію сульфату, можна обчислити його масу: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025моль · 233,393 г/моль = 5,835г Реакції та кількості субстратів, наведені в завданні, утворюють 5,835г осаду барій сульфату.
Щоб реакція пройшла повністю, маючи 0,010 моль Al 2 (SO 4 ) 3 , необхідно додати в систему 0,030 моль BaCl 2 . Однак реагує лише 0,025 моль хлориду барію, що означає його дефіцит і обмежить реакцію. Тому кількість осаду, що утворюється в реакції, слід розраховувати за кількістю цього субстрату. Кількість молей хлориду барію, використаного відповідно до стехіометрії реакції, дорівнює кількості молей утвореного осаду, таким чином: n BaSO4 = n BaCl2 0,025 моль BaSO 4 = 0,025 моль BaCl 2 Знаючи кількість молей барію сульфату, можна обчислити його масу: m BaSO4 = n BaSO4 · M BaSO4 m BaSO4 = 0,025моль · 233,393 г/моль = 5,835г Реакції та кількості субстратів, наведені в завданні, утворюють 5,835г осаду барій сульфату.
