Шкала pH використовується для визначення ступеня кислотності або лужності розчину за кількісною шкалою, яка містить абсолютні числа від 0 до 14. Вона базується на молярній активності іонів гідроній [H 3 O +] в досліджуваній рідині. Шкала була розроблена в 1909 році датським біохіміком С. Соренсеном, а літери «p» і «H» позначають відповідно латинське «potentio» (потужність) і атом водню, який позначається в періодичній системі Менделєєва. як 'H' (гідрогеній). Шкала pH відображає і те, і інше: для визначення рівня pH ми використовуємо показник степеня зі зміненим знаком для позначення протонів, що містять водень. Рівень pH будь-якого отриманого розчину є однією з його найважливіших хімічних характеристик і фактором, який визначає хід і швидкість багатьох хімічних реакцій, а також тип утворених речовин.

Диференціація за шкалою
Шкала pH включає п’ятнадцять градусів, де середнє значення (7) вказує на нейтральний pH. Розчини, розташовані близько до 0, називаються сильними кислотами, тоді як ті, що знаходяться на протилежній стороні, близькі до 14, називаються сильними основами. Кислий рН означає, що розчин містить забагато іонів водню [H 3 O +], а основний рН означає, що в розчині забагато гідроксид-іонів [OH –]. Шкала рН найчастіше згадується в контексті розчинів, але абсолютний хімічний потенціал протона робить її застосовною в усіх агрегатних станах. Це дозволяє нам безпосередньо порівнювати рівень лужності практично будь-якої речовини.
Самодисоціація води
Щоб повністю зрозуміти сенс шкали pH, нам потрібна спонтанна реакція самодисоціації води, яка протікає згідно з наступним рівнянням:  Це оборотний процес, константа рівноваги якого зсувається в ліву частину рівняння, тобто до недисоційованої води.
Це оборотний процес, константа рівноваги якого зсувається в ліву частину рівняння, тобто до недисоційованої води.
Як розрахувати рівень pH?
Незважаючи на помилково визначене початкове припущення, що визначення стосується концентрації іонів водню [H +], найпопулярнішою формулою все ще є наступна:  Сьогодні ми вже знаємо, що розчини не містять водних іонів водню, тобто протонів, присутніх у воді, завдяки безпосередньому процесу сольватації. Це явище призводить до відсутності вільних протонів і наявності іонів гідроній [H 3 O +], що спричинено спонтанною необоротною реакцією:
Сьогодні ми вже знаємо, що розчини не містять водних іонів водню, тобто протонів, присутніх у воді, завдяки безпосередньому процесу сольватації. Це явище призводить до відсутності вільних протонів і наявності іонів гідроній [H 3 O +], що спричинено спонтанною необоротною реакцією: 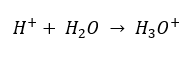 Тому правильний запис формули такий:
Тому правильний запис формули такий: 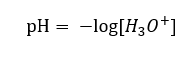
Середовище позначається за шкалою pH
Прийнято, що концентрація гідроній-іонів у чистій воді при кімнатній температурі (25 o C) становить 10 -7 моль/дм 3 , тому рівень її pH можна розрахувати наступним чином: 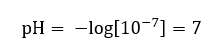 Це узгоджується з тим, що вода, будучи нейтральною, знаходиться в середині шкали, що свідчить про хімічну інертність речовини. Це також доводить, що вода містить рівну кількість гідроксид-аніонів і гідроній-катіонів. Однак у кислотах і основах ця рівновага порушується. Негативний показник свідчить про співвідношення, де чим нижчий рівень pH, тим вища потужність досліджуваного розчину. Термін «сила» в контексті шкали рН означає той факт, що значення 0 приймають сильні, навіть подразнюючі кислоти, тоді як значення 14 відноситься до найсильніших лужних речовин.
Це узгоджується з тим, що вода, будучи нейтральною, знаходиться в середині шкали, що свідчить про хімічну інертність речовини. Це також доводить, що вода містить рівну кількість гідроксид-аніонів і гідроній-катіонів. Однак у кислотах і основах ця рівновага порушується. Негативний показник свідчить про співвідношення, де чим нижчий рівень pH, тим вища потужність досліджуваного розчину. Термін «сила» в контексті шкали рН означає той факт, що значення 0 приймають сильні, навіть подразнюючі кислоти, тоді як значення 14 відноситься до найсильніших лужних речовин.
Додавання кислоти у воду
Зміна pH від нейтрального рівня може бути викликана додаванням речовин різної потужності. Наприклад, якщо ми додамо одну з найсильніших кислот ( соляну кислоту, HCl ) до води, це спричинить дисоціацію кислоти за такою реакцією:  На відміну від самодисоціації води, рівновага кислотної дисоціації значно зміщена вправо. Отже, якщо цю кислоту розчинити в екологічно інертній воді, це збільшить кількість присутніх у воді іонів гідроній і, як наслідок, збільшить їх молярну активність. Наприклад, за реакцією дисоціації соляна кислота з концентрацією 1 моль/дм 3 вводить у розчин іони гідроній з концентрацією 1 моль/дм 3 . Рівень pH для такого розчину соляної кислоти можна розрахувати за такою формулою:
На відміну від самодисоціації води, рівновага кислотної дисоціації значно зміщена вправо. Отже, якщо цю кислоту розчинити в екологічно інертній воді, це збільшить кількість присутніх у воді іонів гідроній і, як наслідок, збільшить їх молярну активність. Наприклад, за реакцією дисоціації соляна кислота з концентрацією 1 моль/дм 3 вводить у розчин іони гідроній з концентрацією 1 моль/дм 3 . Рівень pH для такого розчину соляної кислоти можна розрахувати за такою формулою: 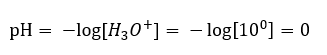
Додавання основи у воду
У протилежному випадку, коли ми додаємо сильну основу у воду, концентрація гідроній-іонів знизиться. Наприклад, гідроксид натрію , концентрований при 1 моль/дм 3 , аналогічно матиме таку саму концентрацію, але інших іонів (гідроксид-іонів), відповідно до реакції, яку він зазнає під впливом води:  У такому випадку можна опосередковано розрахувати рН, використовуючи наступну додаткову формулу рОН:
У такому випадку можна опосередковано розрахувати рН, використовуючи наступну додаткову формулу рОН: 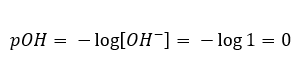 Якщо ми знаємо, що:
Якщо ми знаємо, що: 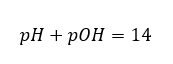 ми можемо легко обчислити, що рН розчину сильної основи (NaOH), концентрованого при 1 моль/дм 3, має рН 14.
ми можемо легко обчислити, що рН розчину сильної основи (NaOH), концентрованого при 1 моль/дм 3, має рН 14. 
Рівень pH за шкалою?
Оскільки шкала pH спочатку була розроблена для цілей розведених розчинів, можливо, що сильні кислоти або основи перевищують її, опускаючись нижче 0 або вище 14. Це тому, що шкала марна для високих концентрацій, де pH більше не є логарифмічним. функція іонів гідроній [H 3 O +]. Тоді ми використовуємо різні значення, які виникають із постійних рівноваг дисоціації кислот і основ.
Методи визначення рН розчину
Для емпіричного визначення рН середовища використовують так звані кислотно-лужні індикатори. На практиці це речовини, які змінюють свій колір під впливом різних умов pH. Існує три види таких індикаторів:
- Індикатори, які змінюють свій колір у базовому середовищі, наприклад:
- безбарвний фенолфталеїн стає малиновим,
- безбарвний тимолфталеїн синіє.
- Індикатори, які змінюють свій колір у кислому середовищі, наприклад:
- метиловий оранжевий змінює свій колір з оранжевого на червоний,
- бромтимоловий синій змінює свій колір з синього на жовтий.
- Універсальні показники, наприклад:
- бромтимоловий синій жовтіє в кислотах і синіє в основах,
- лакмус червоніє в кислотах або синіє в основах.
Також прийнято змочувати лакмусові папірці в суміші різних індикаторних речовин, що збільшує діапазон рівнів pH. Крім того, багато лабораторій використовують готові універсальні лакмусові папірці, які змінюють кольори в діапазоні від червоного до зеленого, відповідним чином пропонуючи перевірений pH на основі супровідної шкали. Таке визначення дозволяє оцінити лише значення pH з точністю до 0,5 одиниці за шкалою pH. Більш точним методом вимірювання рН є кислотно-основне титрування, що включає підвиди алкаліметрії (титрування стандартизованим розчином основи) і ацидиметрії (титрування стандартизованим розчином кислоти). Він використовує титрант з відомою концентрацією, який, реагуючи з досліджуваною речовиною, безперервно змінює концентрацію присутніх у розчині іонів гідроній. Таке визначення можна проводити двома способами: візуально, при визначенні кінцевої точки, разом зі зміною кольору або за допомогою інструментальних методів, наприклад потенціометрії або кондуктометрії. Як випливає з назви, використання pH-метра також дає нам змогу визначити значення pH речовини. Прилад, що працює на основі потенціометрії, має комірку в двох однакових електродах. Один з них, який називається індикаторним електродом, необхідно помістити в досліджуваний розчин. Інший (порівняльний електрод) поміщають у стандартний розчин із відомим значенням pH. Зазвичай використовуваною речовиною є розчин хлориду срібла. Обидва електроди з’єднані з надзвичайно чутливим вольтметром, який безперервно перетворює ЕРС (електрорушійну силу) в певний результат за шкалою pH. Відповідно до теорії Нернста, електрорушійна сила (ЕРС) клітини, що складається з двох однакових електродів, занурених у розчини з різними значеннями pH, прямо пропорційна логарифму частки обох концентрацій.
Домашні методи вимірювання рН
Виявляється, існує багато природних індикаторів pH , і приблизне значення pH можна виміряти в домашніх умовах. Наприклад, настій з листя чорного чаю стає яскравішим, якщо його змішати з кислотою, наприклад, лимонним соком. І навпаки, темніє під впливом основ, наприклад розчину харчової соди. Сік червонокачанної капусти змінює свій колір з фіолетового на червоний при впливі кислоти або на синій при змішуванні з основою.
