Електронегативність — це величина, яка відображає тенденцію даного атома в молекулі притягувати до себе електрони. На практиці це здатність атома або функціональних груп притягувати електронну густину. Найбільш часто використовуваною шкалою, пов’язаною з цією величиною, є шкала, запроваджена Лінусом Полінгом, яка дає змогу легко обчислити приблизну природу зв’язку.

Характеристики електронегативності
Гомоядерні молекули, наприклад H 2 і O 2 , мають рівні коефіцієнти c A і c B на своїх молекулярних орбіталях, які можна записати у вигляді хвильових функцій: Ψ +AB = c A Ψ A + c B Ψ B Ψ −AB = c A Ψ A − c B Ψ B У цьому випадку орбіталь характеризується тим, що її форма симетрична відносно центру молекули, а її електричний заряд рівносиметрично розподілений в ній. Однак іншим прикладом є гетероядерні молекули, в яких практично неможливо зберегти рівні коефіцієнти, а також повну симетрію відносно центру молекули. Коли енергетичний рівень атомної орбіталі Ψ B нижчий за енергетичний рівень атомної орбіталі Ψ A , виникає співвідношення, і максимум густини ймовірності електронів зміщується в бік атома B. На практиці це призводить до зсуву електрона пара в хімічному зв’язку, тобто поляризація до атома B. Наприклад, у молекулі гідриду літію LiH цей зсув відбувається до атома водню, тоді як у молекулі фтористого водню HF він до атома фтору. Це означає, що атом водню має нижчий рівень енергії, ніж літій, але вищий рівень енергії, ніж фтор (читайте про галогени ). За цих умов один з атомів обох молекул приймає негативний заряд, позначений як -δ, а інший – позитивний +δ. Загальна формула такої молекули А +δ В -δ .
Заряди атомів
Зазначений вище заряд δ може приймати різні значення в залежності від елементів, зв’язаних хімічним зв’язком . Його значення 0 означає, що заряд електронної пари розподілено симетрично і пара розташована повністю поблизу атома з нижчим енергетичним рівнем, що призводить до передачі обох електронів цьому атому. Це створює іонний зв’язок між елементами. Однак у переважній більшості хімічних зв’язків є дробові заряди, що призводить до стану між ковалентним та іонним зв’язком.
Дипольний момент
Диполь – це молекула, в якій можна виділити два полюси – позитивний і негативний. Дипольний момент, позначений μ, є мірою величини зсуву електричного заряду в ньому. Він визначається як добуток абсолютного значення електричного заряду (δ), що міститься в одному з полюсів, на відстань від цих полюсів (l): μ = δ · l Позитивний заряд (δ+) і негативний заряд ( δ-) називається частковим зарядом, і його розташування приписується конкретному атому, але насправді це лише більша чи менша ймовірність присутності електрона навколо його ядер. Подібне явище іноді плутають із процесами окиснення та відновлення , але на відміну від змін, які в них відбуваються, такі заряди, що приймаються атомами, не спричиняють їх переходу в інший ступінь окиснення, тому між ними не відбувається обміну електронами. їх. Одиницею СІ для вираження дипольного моменту є кулон-метр (Кл·м). Однак у розрахунках найчастіше використовується одиниця, записана в системі CGS, дебай (D). Один дебай відповідає значенню 3,33564·10 -30 Кл·м. Найбільший теоретично можливий дипольний момент характеризує молекули з чисто іонним зв’язком. Тоді як найменший має місце в молекулах, зв’язок яких є суто ковалентним – у цьому випадку дипольний момент дорівнює нулю. Однак більшість є проміжними випадками з різними характерами частинок.
Дипольний момент галогенів
Деякі зв’язки між електронегативністю та дипольним моментом можна легко спостерігати на конкретних хімічних сполуках. Таблиця 1 Дипольні моменти галогеноводнів
| З’єднання | Експериментально визначений дипольний момент [ μ, D] | Довжина зв’язку [pm] | Добуток заряду елемента на довжину диполя [e ·l, D] | Частка іонного характеру [ %] | Різниця в електронегативності галогену та водню |
| HF | 1,98 | 92 | 4.42 | 45 | 1.9 |
| HCl | 1.08 | 128 | 6.15 | 18 | 0,9 |
| HBr | 0,79 | 143 | 6.87 | 12 | 0,7 |
| ПРИВІТ | 0,38 | 162 | 7,78 | 5 | 0,4 |
Відношення μ/(e·l’), тобто фактичний дипольний момент до дипольного моменту, який відповідає іонному зв’язку, може забезпечити міру відхилень від повністю ковалентного зв’язку. Добуток цього відношення у формі (μ/(e·l’))·100%представляє відсоток іонного характеру в зв’язку. Це лише приблизне значення, оскільки дипольний момент залежить не тільки від полярності зв’язку, але й від поведінки вільних електронних пар. Трапляється, що електронна хмара може бути зміщена назовні від молекули, внаслідок чого рівняння для визначення її дипольного моменту має додаткову складову. У випадку молекули аміаку хмара спрямована відповідно до дипольного моменту зв’язку, що призводить до збільшення результуючого дипольного моменту. Навпаки, протилежне вірно для молекули оксиду вуглецю, де хмара спрямована в протилежному напрямку і, отже, зменшує результуючий дипольний момент. 
Електронегативність
Це безрозмірна емпірична величина, яка відображає тенденцію даного атома в молекулі притягувати до себе електрони. На практиці це здатність атома або функціональних груп притягувати електронну густину. Найбільш часто використовуваною шкалою, пов’язаною з цією величиною, є шкала, запроваджена Лінусом Полінгом, яка дає змогу легко обчислити приблизну природу зв’язку. Для розрахунку електронегативності окремих елементів вчений використав такий метод: припустимо, що D AA і D BB — це енергії зв’язку двоатомних молекул (A 2 , B 2 ). Ми позначимо енергію зв’язку, яка виникає в молекулі, як D AB . Емпірично було показано, що якщо такий зв’язок містить незначний іонний характер або його взагалі немає, різниця між значеннями D AB і середнім геометричним значень енергії D AA і D BB дорівнює або близька до нуля. Коли зв’язок АВ має явні відхилення від ковалентного характеру, ця різниця набуває позитивних значень, які збільшуються зі збільшенням частки іонного характеру. Різниця між електронегативністю (x) двох атомів, що беруть участь у зв’язку, виражається формулою: ![]() Отже, якщо Полінг у своїх розрахунках припустив, що електронегативність фтору дорівнює 4,0, то можна розрахувати подальшу електронегативність елементів. Якщо ми знаємо значення x A атомів елемента A і значення коефіцієнта Δ’, тоді ми можемо обчислити значення x B за допомогою наведеного вище рівняння. Шкала Полінга побудована таким чином, щоб її значення приблизно узгоджувалися зі значеннями дипольного моменту зв’язку, утвореного атомами, що розглядаються, як це видно з прикладу табл. 1, який містить значення, визначені для галогеноводнерів . Окрім описаної вище шкали, у науковій літературі описано ще декілька, зокрема електронегативність, яку описують:
Отже, якщо Полінг у своїх розрахунках припустив, що електронегативність фтору дорівнює 4,0, то можна розрахувати подальшу електронегативність елементів. Якщо ми знаємо значення x A атомів елемента A і значення коефіцієнта Δ’, тоді ми можемо обчислити значення x B за допомогою наведеного вище рівняння. Шкала Полінга побудована таким чином, щоб її значення приблизно узгоджувалися зі значеннями дипольного моменту зв’язку, утвореного атомами, що розглядаються, як це видно з прикладу табл. 1, який містить значення, визначені для галогеноводнерів . Окрім описаної вище шкали, у науковій літературі описано ще декілька, зокрема електронегативність, яку описують:
- Маллікен, у роботі якого було припущено, що електронегативність елемента прямо пропорційна сумі його спорідненості до електрона та енергії іонізації. Спорідненість до електрона, яка є кількістю енергії, яка виділяється внаслідок приєднання електрона до нейтрального атома, і енергією іонізації, що дорівнює кількості енергії, необхідної для відриву електрона від нейтрального атома. Отже, найвища електронегативність характерна для атомів, які демонструють високу спорідненість до електрона та високу енергію іонізації.
- Оллред і Рохов, які припустили пропорційність електронегативності мірі сили, з якою атомне ядро (Z) діє на валентні електрони, записане як
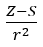 (r – атомний радіус, S – постійна екранування). Відповідно до їхньої теорії електронегативність (x) елементів можна розрахувати за формулою:
(r – атомний радіус, S – постійна екранування). Відповідно до їхньої теорії електронегативність (x) елементів можна розрахувати за формулою:
![]() На кожній шкалі електронегативність водню близька до значення 2,2, інші значення незначно змінюються. Приклади електронегативності елементарних атомів, розраховані за шкалами Полінга, Маллікена та Оллреда та Рохова, наведені в таблиці 2 нижче. Таблиця 2. Електронегативність прикладів елементів за шкалами Полінга (P), Маллікена (M) і Олреда та Рохова (AR).
На кожній шкалі електронегативність водню близька до значення 2,2, інші значення незначно змінюються. Приклади електронегативності елементарних атомів, розраховані за шкалами Полінга, Маллікена та Оллреда та Рохова, наведені в таблиці 2 нижче. Таблиця 2. Електронегативність прикладів елементів за шкалами Полінга (P), Маллікена (M) і Олреда та Рохова (AR).
| атом | П | М | AR |
| Ф | 3,98 | 3.90 | 4.10 |
| О | 3.44 | 3.04 | 3.50 |
| Н | 3.04 | 2.28 | 3.07 |
| Кл | 3.16 | 2,95 | 2.83 |
| C | 2.55 | 1.75 | 2.50 |
| Х | 2.20 | 2.21 | 2.20 |
| Si | 1.90 | 2.25 | 1.74 |
| Ф | 0,82 | 0,77 | 0,91 |
| руб | 0,82 | 0,50 | 0,89 |
| Cs | 0,79 | – | 0,86 |
| О | 0,70 | – | 0,86 |
Незважаючи на розбіжності в розрахунках трьома методами, фтор має найвищу електронегативність на кожній шкалі, за ним йдуть кисень, азот і хлор . Найнижчі значення були визначені для францію, цезію, рубідію та калію. Елементи, які зазвичай є неметалами, мають електронегативність вище 2, типові метали мають електронегативність нижче 2. Стандартним значенням є згадана вище електронегативність водню приблизно 2,2. 
Електронегативність у періодичній системі
Як і багато інших властивостей, електронегативність також відображається в розташуванні хімічних елементів у періодичній таблиці . У групі електронегативність зменшується зі збільшенням числа оболонок і металевого характеру, тому вона зростає в напрямку від францію до водню. З часом електронегативність зростає зі збільшенням наявних валентних електронів і зменшенням неметалічного характеру, тобто від металів до благородних газів .
Електронегативність і тип зв’язку – короткий зміст
Знаючи індивідуальні значення електронегативності елементів, що утворюють хімічний зв’язок, можна зробити висновок про його природу. Якщо різниця між 0,0 і 0,4, зв’язок є ковалентним. Коли різниця становить від 0,4 до 1,7, зв’язок є поляризованим ковалентним. Різниця вище 1,7 в електронегативності елементів свідчить про іонний зв’язок.
