Це один із двох основних розділів аналітичної хімії, який займається виявленням хімічних елементів, функціональних груп або іонів, що існують у досліджуваній структурі. За використовуваними методами хімічний аналіз можна розділити на класичний та інструментальний. Класичний аналіз спирається на методи, засновані на хімічних реакціях, які можуть проводитися в «сухому» або «мокрому» режимі. Навпаки, інструментальний аналіз спирається на прилади, тобто аналітичні вимірювальні прилади, основним елементом яких є детектор.

Класичний аналіз: сухі реакції
Термін «сухі реакції» стосується змін, які відбуваються в хімічних сполуках під час дії на них високих температур. Розрізняємо три основних види таких реакцій:
- плавлення досліджуваного зразка твердими флюсами,
- отримання кульок бури або мікрокосмічної солі,
- фарбування полум’я газового пальника.
Найбільш популярним є третій метод, який називається тестом на полум’я і дозволяє виявити багато елементів. Це приклад техніки, яка використовує випромінювання. Він полягає у вивченні характеристичного випромінювання, яке випускають атоми певних елементів, коли вони збуджуються високою температурою. Це пов’язано з тим, що було продемонстровано, що такі умови викликають випаровування сполук певних металів, а утворені пари збуджуються та забарвлюють полум’я пальника характерним чином. Колір є ефектом збудження окремих атомів, які, повертаючись до свого початкового стану, випромінюють квант світла, який відноситься до певної довжини хвилі. Наприклад, кольори полум’я, характерні для окремих елементів, такі:
- натрій: інтенсивний жовтий,
- калій: фіолетовий,
- кальцій: цегляно-червоний,
- барій: зелений,
- вісмут: світло-блакитний.
Класичний аналіз: вологі реакції
Це всі види реакцій, що відбуваються між досліджуваними зразками та розчинами різних хімічних реагентів . Для здійснення таких реакцій досліджувану речовину необхідно перевести в розчин. Застосовувані реакції вибираються на основі багатьох критеріїв, щоб вони:
- виявляють високу чутливість, тобто виникають вже при малих концентраціях речовини, що виявляється;
- відбуваються за короткий проміжок часу та демонструють легко помітні зміни, такі як зміна кольору розчину, випадання опадів або виділення газу;
- є селективними, тобто виникають лише в межах відомої групи іонів.

Якісний аналіз: неорганічна хімія
У неорганічній хімії якісний аналіз обертається навколо двох тем: виявлення катіонів та аніонів. Неорганічна хімія використовує характерні реакції, які включають реагенти відповідної групи. Їх називають «груповими реагентами», оскільки катіони поділено на п’ять категорій. Такий реагент утворює осад лише з одним із них, що дає змогу звузити типи присутніх у зразку катіонів за такою схемою:
- Група 1: Ag + , Hg 2 2+ , Pb 2+ – груповий реактив 3М HCl;
- Група 2: Hg 2+ , Cu 2+ , Cd 2+ , Bi 3+ , As 3+ , As 5+ , Sb 3+ , Sb 5+ , Sn 2+ , Sn 4+ – груповий реагент H 2 S в ан. 1М середовище HCl;
- Група 3: Ni 2+ , Co 2+ , Fe 2+ , Fe 3+ , Mn 2+ , Zn 2+ , Al 3+ , Cr 3+ – груповий реагент (NH 4 ) 2 S в амонійному буферному середовищі;
- 4 група: Ca 2+ , Sr 2+ , Ba 2+ – груповий реактив (NH 4 ) 2 CO 3 в амонійному буферному середовищі;
- 5 група: Mg 2+ , Na + , K + , NH 4 + – груповий реагент відсутній.
Як тільки ми виключимо певні групи катіонів, ми можемо продовжити ідентифікацію з використанням інших реагентів, цього разу тих, які є характерними для конкретних іонів. Така реакція дозволяє однозначно ідентифікувати. Наприклад, виявлення іонів Ag + в зразку відбувається в два етапи:
- Реакція з груповим реактивом: утворення білого осаду
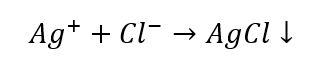
- Характерна реакція: розчинення осаду AgCl у водному розчині аміаку з отриманням безбарвної комплексної сполуки.
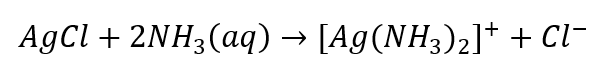
Подібним чином можна визначити аніони, які поділяються на три групи:
- Група 1: BO 2 – , CO 3 2- , C 2 O 4 2- , SiO 3 2- , PO 4 3- , AsO 3 3- , AsO 4 3- , SO 3 2- , S 2 O 3 2- , SO 4 2- , F – , CrO 4 2- , Cr 2 O 7 2- – груповий реагент BaCl 2 , утворення малорозчинних у воді солей;
- 2 група: C 4 H 4 O 6 2- , S 2- , Cl – , ClO – , Br – , I – , CN – , SCN – – груповий реагент AgNO 3 , утворення солей, важкорозчинних у воді та розведених розчинах. азотна кислота;
- 3 група: CH 3 COO – , NO 2 – , NO 3 2- , ClO 3 – , ClO 4 – , MnO 4 – – груповий реактив містить катіони срібла або барію; утворення водорозчинних солей.
Ідентифікація катіонів є дещо більш проблематичною порівняно з аніонами, оскільки послідовність процедур залежить від результатів групових реакцій, крім того, існують іони, які заважають процесу ідентифікації. Наприклад, щоб виявити іон CO 3 2- , ми повинні провести такі реакції:
- Іони Ba 2+ утворюють білий осад, який розчиняється в кислотах
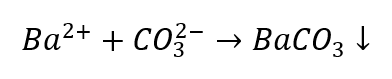
- Розбавлені кислоти викликають розкладання з випаданням CO 2
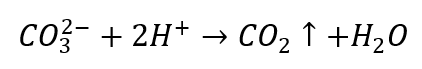
- Вуглекислий газ викликає пузиріння розчину. Його можна залити вапняною водою, так як випаде білий осад.
* Тривожні іони: SO 3 2- і S 2 O 3 2- також утворюють білі осади з катіоном кальцію. Щоб усунути порушення, їх необхідно окислити. 
Якісний аналіз: органічна хімія
Якісний аналіз органічних сполук включає кілька етапів, і ключовим моментом є вирішення п’яти фундаментальних питань:
- Аналіз фізичних параметрів, таких як температура плавлення або кипіння. На жаль, існує багато хімічних сполук з однаковими температурними точками, і на саме вимірювання може вплинути помилка. Однак, якщо у нас є відповідний еталонний стандарт, цей метод може дозволити нам швидко ідентифікувати сполуку. Крім того, за допомогою вимірювання температури ми можемо визначити чистоту сполуки, оскільки температурні діапазони вузькі. Постійність T top після принаймні однієї кристалізації також може свідчити про високу чистоту сполуки. Для рідин це може вказувати на вузький діапазон дистиляції.
- Дослідження елементного складу дозволяє виключити або підтвердити наявність окремих типів органічних сполук. Для прикладу, виключаючи присутність атомів азоту в структурі, ми також виключаємо присутність аміно- або азотистих груп. З цією метою ми проводимо характерні експерименти, такі як тест Лассеня для азоту, тест Бейльштейна для галогенів або тест сірки з використанням нітропрусиду натрію.
- Перевірка розчинності сполуки дозволяє віднести її до групи сполук із заданими хімічними властивостями. За принципом «подібне розчиняється подібним» сполуки поділяють на 7 категорій.
- Ідентифікація функціональних груп вимагає відповідних аналітичних реакцій, які дозволяють виключити або ідентифікувати функціональні групи.
- Спектральний аналіз є найбільш надійним пунктом, який дозволяє чітко ідентифікувати хімічну сполуку. Він охоплює всі інструментальні техніки, такі як:
- Мас-спектрометрія (МС) , яка полягає в іонізації молекул і виявленні кількості іонів шляхом визначення їх співвідношення маси до заряду. Це дозволяє зробити висновки про масу досліджуваної сполуки;
- Спектроскопія ядерного магнітного резонансу (ЯМР) , яка надає конкретну інформацію про структуру. Він надає зображення магнітних ядер ( 13 C, 1 H), що дозволяє детально інтерпретувати їх якість;
- Інфрачервона (ІЧ) спектроскопія використовує вузький діапазон електромагнітного випромінювання, щоб показати типи коливань, які існують у досліджуваній молекулі.
