Термін «елемент» відноситься до атомів, ядра яких містять певну кількість протонів. Крім них, до складу атомного ядра входять також інші молекули: нейтрони. Їх кількість в межах одного елемента може бути різною. У такому випадку ми говоримо про ізотопи, тобто варіанти даного елемента, які мають різну кількість нейтронів у своєму ядрі. Таким чином, їх масові числа також різні. Однак атомний номер залишається постійним, оскільки кількість електронів на електронних оболонках залишається незмінною.

З цієї причини ізотопи одного елемента займають однакове положення в періодичній системі, і кожен з них має однаковий розмір. Крім того, їхні хімічні та фізичні властивості схожі. Однак є винятки, коли фізичні властивості більш різноманітні, що зазвичай відбувається, коли ми маємо справу з двома ізотопами зі значними відмінностями в масі. Це пов’язано з тим, що саме маса визначає цілий ряд властивостей, таких як щільність або швидкість дифузії частинок. Навпаки, такі параметри, як електропровідність або колір, не залежать від маси. Різноманітність хімічних властивостей зазвичай походить від неоднакових швидкостей реакції різних ізотопів.
Нукліди проти ізотопів
Існує поняття, пов’язане з ізотопами, яке є більш загальним. Нуклід — це цілий набір атомів, ядерна структура яких конкретно визначається кількістю протонів і нейтронів. Це означає, що два нукліди, які відрізняються числом нейтронів, можуть бути ізотопами. На практиці всі ізотопи є нуклідами, але не кожен нуклід обов’язково є ізотопом. Основна ідея цих двох концепцій охоплює хімічні властивості у випадку ізотопів і ядерні властивості у випадку нуклідів. Наприклад:
- Нукліди, які є ізотопами:
- Нукліди, які не є ізотопами:
Ізотопи в природі
Хімічні елементи, що існують у природному середовищі, є сумішшю ізотопів із постійним процентним складом. Залежно від ядра елемент може містити один, кілька або більше ізотопів. Деякі з них стабільні, але деякі швидко трансформуються. При такому розкладанні можуть утворюватися ізотопи того самого або іншого елемента. Такі переходи зазвичай відбуваються разом з випромінюванням. Якщо використовувати конкретні значення, то на Землі є елементи, атомні номери яких дорівнюють або нижчі за 92. Ті, що мають номери до 83, вважаються стабільними. Існує 81 природний елемент, який має стабільні ізотопи. До них відносяться кремній з ізотопами 28 Si, 29 Si і 30 Si, залізо з ізотопами 54 Fe, 56 Fe, 57 Fe і 58 Fe або алюміній, який має лише один стабільний ізотоп: 27 Al.
Ізотопи водню
У природі ми можемо знайти три ізотопи водню, які утворюють суміш елементів. На практиці ізотопи 1 H (водень-1) і 2 H (водень-2) складають більшість, відповідно, 99,985%і 0,015%від загальної кількості водню. Ізотоп 3 H (водень-3) нестабільний і містить лише деякі слідові кількості. Водень-1 є найвідомішим протиєм, водень-2 (також званий дейтерієм) складається з одного протона й одного нейтрона, а ядро останнього ізотопу (водню-3, тобто тритію) містить один протон і два нейтрони. З цієї причини різниця в масі між цими ізотопами значна: атом дейтерію вдвічі важчий за атом протію, а тритій навіть утричі важчий за протій. Як відомо, водень у будь-якій ізотопній формі існує як двоатомна молекула. Виявляється, він також може утворювати молекули, що містять різні ізотопи, тобто HD (протій-дейтерій), HT (протій-тритій) і DT (дейтерій-тритій). Дейтерій — нерадіоактивний ізотоп високої стабільності. Його іноді називають важким воднем. Якщо в молекулі води (D 2 O) замінити водень-1 на дейтерій, молекула змінить свої властивості: температура плавлення підвищиться приблизно на 1,5 o C, а температура замерзання знизиться на цілих 3,81 o C. Його щільність також збільшиться відносно H 2 O приблизно на 0,1%. Навпаки, тритій є дуже нестабільним ізотопом, який також є радіоактивним. Його ядро є місцем спонтанного радіоактивного розпаду, в результаті якого утворюються атоми гелію. Якщо порівняти фізико-хімічні властивості ізотопів, то виявимо істотні відмінності, які наведені в таблиці 1. Таблиця 1. Порівняння основних фізико-хімічних показників ізотопів водню.
| Ізотоп | символ | Щільність [g /l] | Температура плавлення [K] | Температура кипіння [K] |
| Протіум | Х | 0,08233 | 13.83 | 20.27 |
| Дейтерій | Д | 0,1645 | 18.73 | 23,67 |
| Тритій | Т | 0,2464 | 20.62 | 25.04 |
Ізотопи вуглецю
Вуглець має три відомі ізотопи: 12 C, 13 C і 14 C, кожен з яких має однакові хімічні властивості. Найпоширенішим є вуглець-12, який становить 98,89%усіх атомів. Ізотоп 13 C, існуючий на Землі, становить близько 1,11%, тоді як атом 14 C зустрічається приблизно в одному на 10 12 . Останній схильний до спонтанного розкладання, що викликає випромінювання бета-випромінювання. Потім ізотоп перетворюється на атом азоту. Стабільний ізотоп вуглецю-13. Завдяки ненульовому спіну його можна застосовувати в ядерному магнітному резонансі 13 ЯМР.
Застосування ізотопів
У датчиках диму ми використовуємо нестабільні ізотопи 241 Am або 238 Pu, які характеризуються повільним розкладанням у поєднанні з випромінюванням. Коли з’являється дим, випромінювання блокується і більше не досягає детектора, таким чином спрацьовуючи тривогу. Радіація розкладання деяких елементів здатна знищувати мікроорганізми, тому ізотопи, в тому числі 60 Co, можна використовувати для консервування харчових продуктів. У медичній діагностиці певні ядра використовуються для виявлення змін в досліджуваних органах, наприклад, у нирках або серці. Такий ізотоп зв’язується з біологічно неактивною речовиною, що має відомий шлях в організмі, і вводить його в систему кровообігу. Це дає можливість відстежувати шлях випромінювання та спостерігати, як воно накопичується в тканинах і органах. При лікуванні пухлин ми також застосовуємо променеву терапію, засновану на випромінюванні нестабільних ізотопів, таких як 226 Ra і 60 Co. Метою такої терапії є знищення пухлинних клітин. Один із ізотопів вуглецю 14 C використовується для визначення віку матеріалів органічного походження. Це нестійке ядро повільно розкладається, і якщо організм гине (а саме тоді припиняється засвоєння вуглецю), його концентрація вуглецю-14 зменшується пропорційно рокам. Деякі ізотопи, наприклад 239 Pu і 235 U, використовуються на атомних електростанціях. Під час розкладання цих нестабільних ядер виробляється енергія, яка, у свою чергу, може бути перетворена в електрику.
Атомна маса та ізотопи
Атомна маса елементів, представлена в періодичній системі, насправді є усередненою масою. Коли ми обчислюємо його, ми беремо до уваги кількість (n) і відсотковий склад (x n ) кожного ізотопу відповідного елемента за такою формулою: 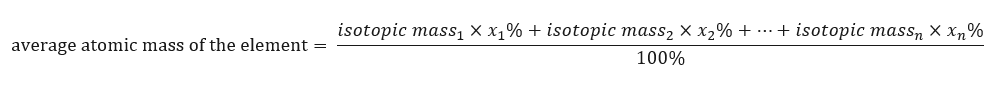 Наприклад, при розрахунку середньої атомної маси водню ми отримаємо таке рівняння:
Наприклад, при розрахунку середньої атомної маси водню ми отримаємо таке рівняння: 
