Термін «рН-буфери» стосується таких водних розчинів, які не змінюють свого значення рН, незважаючи на введення невеликої кількості лугів чи кислот або під час розведення. Практично це суміші розчинів слабких кислот і їх солей з концентрованими сильними основами (донор протона – акцептор протона) або, аналогічно, суміші розчинів слабких основ і їх солей з сильними кислотами. Основна мета використання буферних розчинів полягає в тому, що вони діють як агенти, які дозволяють підтримувати значення рН на досить стабільному рівні. Вони часто використовуються в широкому діапазоні хімічних застосувань, наприклад, у виробництві барвників, під час процесів бродіння, а також для визначення значення pH харчових продуктів, косметики та фармацевтичних препаратів.
Рівняння Гендерсона-Гассельбаха
Основна залежність значення pH буфера від pK a або pK b , що використовуються для кислоти або основи, відповідно, а також від співвідношення концентрацій кислоти та її кон’югованої основи або, аналогічно, основи та її кон’югованої кислоти, є визначається рівнянням Хендерсона-Гассельбаха. Він показує кореляцію між силою застосованої кислоти та значенням pH. Для зразка реакції буфера, отриманого з використанням слабкої кислоти, процедура виглядає наступним чином: HA + H 2 O ↔ H 3 O + + A – Тоді як кореляція між [A –], тобто молярною концентрацією кон’югованої основи [mol ·dm -3], [HA], яка є молярною концентрацією недисоційованої кислоти, а pK a – від’ємним логарифмом рівноважної константи дисоціації кислоти (K a ), виражена за допомогою рівняння Гендерсона-Гассельбаха для такої реакції, має такий вигляд: 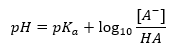
Рівняння Хендерсона-Гассельбаха для ацетатного буфера
Механізм дії буферів заснований на наявності іонів, які здатні зв’язувати іони водню або гідроксиду. Розглядаючи ацетатний буфер, який є сумішшю оцтової кислоти та ацетату натрію, слід звернути увагу на реакцію дисоціації між слабкою оцтовою кислотою та сильним електролітом ацетатом натрію (CH 3 COONa), який повністю дисоціює на іони: CH 3 COOH ↔ H + + CH 3 COO – CH 3 COONa → CH 3 COO – + Na + Оскільки буферний розчин є сумішшю цих іонів, додавання невеликої кількості сильної кислоти вводить [H + } } іони, які негайно зв’язуються аніонами CH 3 COO – з утворенням оцтової кислоти, яка в цих умовах не дисоціює. Як наслідок, це знижує значення pH. Так само надходження додаткових ОН – катіонів шляхом введення в розчин сильної основи не підвищить рівень pH. Вони будуть негайно зв’язані іонами H + , що утворюються в результаті дисоціації оцтової кислоти на недисоційовані молекули води. Рівняння, що визначає константу кислотної дисоціації, подано нижче: 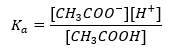 Для дисоціації слабкої оцтової кислоти загальна концентрація аніону CH 3 COO – визначається концентрацією іонів, що утворюються в результаті дисоціації солі, яка, в свою чергу, дорівнює концентрації солі (c s ), тобто ацетат натрію. Висока концентрація цих аніонів спричиняє зниження концентрації катіонів H + і, отже, знижується ступінь кислотної дисоціації, щоб підтримувати значення K a стабільним. Завдяки цій залежності також можна вважати, що кількість недисоційованих молекул CH 3 COOH практично однакова загальній концентрації оцтової кислоти (c k ). Ось чому константу дисоціації можна записати так:
Для дисоціації слабкої оцтової кислоти загальна концентрація аніону CH 3 COO – визначається концентрацією іонів, що утворюються в результаті дисоціації солі, яка, в свою чергу, дорівнює концентрації солі (c s ), тобто ацетат натрію. Висока концентрація цих аніонів спричиняє зниження концентрації катіонів H + і, отже, знижується ступінь кислотної дисоціації, щоб підтримувати значення K a стабільним. Завдяки цій залежності також можна вважати, що кількість недисоційованих молекул CH 3 COOH практично однакова загальній концентрації оцтової кислоти (c k ). Ось чому константу дисоціації можна записати так: 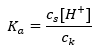 Прологарифмувавши, отримуємо залежність, яка приводить до рівняння Гендерсона-Гассельбаха:
Прологарифмувавши, отримуємо залежність, яка приводить до рівняння Гендерсона-Гассельбаха: 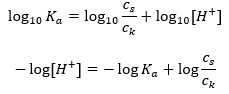 Таким чином, рівняння Хендерсона-Гассельбаха має такий вигляд:
Таким чином, рівняння Хендерсона-Гассельбаха має такий вигляд: 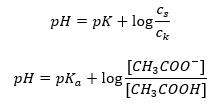 Щоб записати співвідношення, значення pK a у рівнянні насправді є мірою сили кислоти. Будь-які значення pK a нижче 3 (-log(0,001)) є характерними для сильних кислот, тоді як чим вище значення, тим слабша кислота. Факт, що випливає з рівняння Гендерсона-Гассельбаха, є еквівалентністю значення pH буферного розчину та pK a кислоти в момент, коли співвідношення концентрації недисоційованої кислоти та концентрації аніона, утвореного дисоціацією кислоти дорівнює 1, оскільки log(1) дорівнює 0. Такі умови виникають в результаті титрування слабкої кислоти сильною основою, якщо ми додаємо таку кількість основи, яка відповідає половині кількості, необхідної для повної нейтралізації. кислоти. Тоді ступінь титрування розчину становить 50%. У залежності між рН і об’ємом використовуваного титранту значення рН в буферній зоні змінюється відносно повільно.
Щоб записати співвідношення, значення pK a у рівнянні насправді є мірою сили кислоти. Будь-які значення pK a нижче 3 (-log(0,001)) є характерними для сильних кислот, тоді як чим вище значення, тим слабша кислота. Факт, що випливає з рівняння Гендерсона-Гассельбаха, є еквівалентністю значення pH буферного розчину та pK a кислоти в момент, коли співвідношення концентрації недисоційованої кислоти та концентрації аніона, утвореного дисоціацією кислоти дорівнює 1, оскільки log(1) дорівнює 0. Такі умови виникають в результаті титрування слабкої кислоти сильною основою, якщо ми додаємо таку кількість основи, яка відповідає половині кількості, необхідної для повної нейтралізації. кислоти. Тоді ступінь титрування розчину становить 50%. У залежності між рН і об’ємом використовуваного титранту значення рН в буферній зоні змінюється відносно повільно. 
Приклад: амонійний буфер
Іншим типом буфера є амонійний буфер, який являє собою суміш слабкої основи (NH 4 OH) із сильною кислотою (NH 4 Cl). Однак механізм дуже схожий. Сіль, присутня в суміші, піддається повній дисоціації, і її константа є наступним рівнянням: 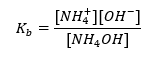 Тоді як в сильному електроліті (NH 4 Cl) амонієва основа практично не дисоціює. З цієї причини ми припускаємо, що концентрація катіона NH 4 + дорівнює концентрації солі, але концентрація недисоційованих молекул NH 4 OH ідентична концентрації основи. Це дає змогу сформулювати рівняння та розрахувати pH цього буфера.
Тоді як в сильному електроліті (NH 4 Cl) амонієва основа практично не дисоціює. З цієї причини ми припускаємо, що концентрація катіона NH 4 + дорівнює концентрації солі, але концентрація недисоційованих молекул NH 4 OH ідентична концентрації основи. Це дає змогу сформулювати рівняння та розрахувати pH цього буфера. 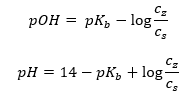 Іони NH 4 + і Cl – і молекули NH 4 OH, присутні в амонійному буфері, призводять до того, що після додавання кислоти або основи відбуваються наступні реакції: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Якщо додавання невелике, зміна у співвідношенні концентрації основної солі, а отже, і зміна рН, також невелика. При десятикратній зміні співвідношення цих концентрацій величина рН зміниться на одиницю.
Іони NH 4 + і Cl – і молекули NH 4 OH, присутні в амонійному буфері, призводять до того, що після додавання кислоти або основи відбуваються наступні реакції: NH 4 OH + H + ↔ NH 4 + + H 2 O NH 4 + + OH – ↔ NH 4 OH Якщо додавання невелике, зміна у співвідношенні концентрації основної солі, а отже, і зміна рН, також невелика. При десятикратній зміні співвідношення цих концентрацій величина рН зміниться на одиницю.
Буферна ємність
Термін «буферна ємність» означає здатність буферного розчину підтримувати приблизно постійну кислотність розчину. Точніше, це кількість грам-еквівалентів сильної кислоти або сильної основи, яка при додаванні до 1 дм 3 буферного розчину змінює його значення рН на одиницю. Формула, що визначає буферну ємність (β), включає її залежність від кількості молей сильної кислоти/основи після додавання до буферного розчину (Δn, [ml]) і зміну рН, що спостерігається під час додавання об’єм сильної кислоти або основи до буферного розчину (ΔpH). ![]() Це значення, яке тісно пов’язане з концентрацією інгредієнтів, яка зростає зі збільшенням. Найбільше значення буферної ємності характеризують буферні розчини, рН яких дорівнює константі дисоціації (pK a ) використовуваної для їх отримання кислоти.
Це значення, яке тісно пов’язане з концентрацією інгредієнтів, яка зростає зі збільшенням. Найбільше значення буферної ємності характеризують буферні розчини, рН яких дорівнює константі дисоціації (pK a ) використовуваної для їх отримання кислоти.
Принцип дії фосфатного буфера
Менш популярним типом буферів є ті буфери, які містять дві кислотні солі. У цьому випадку це дві кислі солі ортофосфорної (V) кислоти, тобто одноосновний фосфат натрію (V) і двоосновний фосфат натрію (V). На відміну від найпоширеніших буферів, які також базуються на принципі Бренстеда сполучених кислотно-основних пар, природу інгредієнтів не так легко визначити. Оскільки аніони, присутні у фосфатному буфері, мають значення, характерні для кислот Бренстеда, ми повинні більш ретельно перевіряти різницю між ними. Відповідно до цього принципу, іон, який є сильнішою кислотою, повинен мати вищу константу дисоціації.
- Для H 2 PO 4 – K a = 6,34·10 -8
- Для HPO 4 -2 K a = 4,36·10 -13
Якщо у нас є такі дані, ми можемо легко стверджувати, що в цьому випадку аніон водню H 2 PO 4 -13 є слабкою кислотою Бренстеда. Механізм роботи буфера базується на динамічній рівновазі, яку можна виразити наступним рівнянням: ![]() Якщо ми додаємо невелику кількість кислоти до буферного розчину, система намагатиметься запобігти змінам pH через реакцію блокування ефекту катіонів [H +] шляхом протонування аніона водню, згідно з наступним рівняння:
Якщо ми додаємо невелику кількість кислоти до буферного розчину, система намагатиметься запобігти змінам pH через реакцію блокування ефекту катіонів [H +] шляхом протонування аніона водню, згідно з наступним рівняння: ![]() Той факт, що саме аніон нейтралізує буфери, додані до розчину, є наслідком того, що саме цей аніон є сильнішою основою Бренстеда. У таких системах ми застосовуємо правило, згідно з яким чим сильніша кислота Бренстеда, тим слабша її сполучена основа. Якщо ми додаємо кислоту до системи, що містить кілька основ Бренстеда, то найсильніша основа буде першою вступати в реакцію. Цей зв’язок є найважливішим компонентом при аналізі рівноваги, що існує в сумішах водних буферних розчинів, що складаються із суміші кислот Бренстеда та суміші слабких основ Бренстеда. Те саме правило, але у зворотному порядку, застосовується, коли ми додаємо основний розчин у фосфатний буфер. Аніони OH – будуть майже негайно захоплені сильнішою кислотою Бренстеда, присутньою в буфері. В даному випадку це буде іон, і реакція буде відбуватися за наступним рівнянням:
Той факт, що саме аніон нейтралізує буфери, додані до розчину, є наслідком того, що саме цей аніон є сильнішою основою Бренстеда. У таких системах ми застосовуємо правило, згідно з яким чим сильніша кислота Бренстеда, тим слабша її сполучена основа. Якщо ми додаємо кислоту до системи, що містить кілька основ Бренстеда, то найсильніша основа буде першою вступати в реакцію. Цей зв’язок є найважливішим компонентом при аналізі рівноваги, що існує в сумішах водних буферних розчинів, що складаються із суміші кислот Бренстеда та суміші слабких основ Бренстеда. Те саме правило, але у зворотному порядку, застосовується, коли ми додаємо основний розчин у фосфатний буфер. Аніони OH – будуть майже негайно захоплені сильнішою кислотою Бренстеда, присутньою в буфері. В даному випадку це буде іон, і реакція буде відбуватися за наступним рівнянням: ![]()
Відомі буфери та їх застосування
- Кров підтримує значення 7,35 і 7,45 одиниць, і її стабільність гарантується наявністю вугільної кислоти, головним чином у формі розчиненого вуглекислого газу та HCO 3- Це буфер, який є слабкою кислотою та її сіллю, а також будь-яким додаванням надмірна кількість кислот або лугів призведе до умов, небезпечних для життя людини. Подібним прикладом буфера є слина, рН якої становить близько 7.
- Амонійний, ацетатний, фосфатний і боратний буфери, відповідно:
- NH 3 + NH 4 Cl pH = 8 – 11;
- CH 3 COOH + CH 3 COONa pH 3,5 – 6;
- K 2 HPO 4 + KH 2 PO 4 pH = 5,5 – 8;
- H 3 BO 3 + Na 2 B 4 O 7 pH = 7 – 9.
Усі популярні буфери застосовуються там, де важливо підтримувати рН на постійному рівні, наприклад:
- в медицині, де їх вводять внутрішньовенно пацієнтам у важкому стані;
- у мікробних культурах, де реакція ґрунту є важливим фактором;
- у роботі з ферментами та білками, для стабілізації середовища для хімічних реакцій;
- у гальваніці, де вони використовуються для електролітичних ванн, оскільки вони дозволяють запобігти швидким, критичним змінам їх рН у зоні біля електрода;
- для калібрування pH-метрів.
