У хімії деякі хімічні сполуки утворюють особливі зв’язки з молекулами води. Це не хімічні зв'язки, а короткочасні взаємодії, які конкретно визначають властивості цих сполук. Мова йде про гідрати. Їх властивості легко використовуються в окремих галузях промисловості. Найпопулярнішою гідратованою сіллю, безсумнівно, є гіпс або дигідрат сульфату кальцію (VI), який є важливою сировиною в будівельній промисловості. Гідрати також є дуже хорошими показниками вмісту вологи. Це пов’язано з тим, що колір безводної солі часто відрізняється від кольору гідратованої солі.

Гідрати
Гідрати не є хімічними сполуками, в яких між молекулами води і молекулами даної солі виникають хімічні зв’язки , наприклад ковалентні . Вони також не є координаційними сполуками. Для цих структур характерно утворення водневих зв’язків, які за міцністю значно слабші за хімічні. Гідрати структуровані у вигляді кристалічної решітки. Молекули води в ньому розподілені нерівномірно. Часто використовується термін «кристалізаційна вода». Гідрати отримують шляхом гідратації . Молекули солі, особливо похідні неорганічної кислоти, швидше за все піддаються цій реакції. Гідратація полягає у перетворенні безводних кристалів у гідратовані. Він може викликати зміну мінеральної маси, але не руйнує її. Гідратація часто супроводжує інші процеси, наприклад карбонізацію. Гідратаційні хімікати за нормальних умов характеризуються високою гігроскопічністю , тобто сильною спорідненістю до молекул води. Такі речовини здатні, наприклад, поглинати вологу з повітря . Інший спосіб одержання гідратів — кристалізація їх із водних розчинів. Молекулярні формули гідратів складаються шляхом запису формули солі та вказівки числа гідратованих молекул води. Для того, щоб забезпечити загальне позначення, буква «n» ставиться перед «H 2 O». Його значення більше одиниці, і воно відповідає кількості приєднаних молекул води. Найбільш поширені відмінності між гідратами з n=½ (напівгідрат), n=1 (моногідрат), n=2 (дигідрат) і n=3 (тригідрат). Важливо, що одна й та сама речовина може приєднувати різну кількість молекул води. ![]()
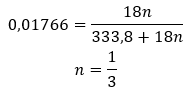 Враховуючи те, що між молекулами солі та молекулами води існують водневі зв’язки , ці сполуки не демонструють задовільної стійкості до підвищених температур. При нагріванні вони розпадаються і переходять у безводну форму. Гідрати дуже добре розчиняються у воді. У водних розчинах гідратовані молекули води, приєднані до солі, вивільняються. Цей факт слід враховувати, наприклад, при виготовленні розчинів цих речовин. Неврахування ступеня гідратації даної сполуки призводить до помилок хоча б у визначенні концентрації розчину. Важливою характеристикою гідратованих солей є зміна їх кольору внаслідок приєднання молекул води в реакції гідратації. Слід зазначити, що гідратовані форми демонструють значно меншу гігроскопічність порівняно з безводними солями.
Враховуючи те, що між молекулами солі та молекулами води існують водневі зв’язки , ці сполуки не демонструють задовільної стійкості до підвищених температур. При нагріванні вони розпадаються і переходять у безводну форму. Гідрати дуже добре розчиняються у воді. У водних розчинах гідратовані молекули води, приєднані до солі, вивільняються. Цей факт слід враховувати, наприклад, при виготовленні розчинів цих речовин. Неврахування ступеня гідратації даної сполуки призводить до помилок хоча б у визначенні концентрації розчину. Важливою характеристикою гідратованих солей є зміна їх кольору внаслідок приєднання молекул води в реакції гідратації. Слід зазначити, що гідратовані форми демонструють значно меншу гігроскопічність порівняно з безводними солями.
Гідрати неорганічних сполук
Солі неорганічних кислот — це речовини, які, безумовно, найімовірніше утворюють гідрати з молекулами води. До найпоширеніших гідратів неорганічних сполук відносяться:
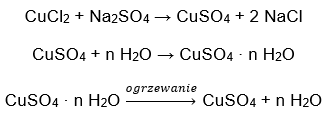
- Купрум (II) сульфат гідрат (VI), CuSO 4 – мідь (II) сульфат (VI) приймає різні ступені гідратації. Максимальна кількість приєднаних молекул води дорівнює п’яти. У результаті нагрівання пентагідрату цієї солі відриваються молекули води. Спочатку утворюються два і тригідрат, а при подальшому нагріванні системи можна отримати моногідрат сульфату міді (II) (VI). Щоб видалити останню молекулу води, необхідно нагріти сполуку до температури понад 200 ᵒC. Гідрати сульфату міді (II) (VI) мають синій колір, що спричинено наявністю кристалізаційної води навколо іонів міді. Тоді як безводна сіль має білий колір. Його висока гігроскопічність і здатність утворювати гідрати використовується для видалення вологи з деяких рідин.
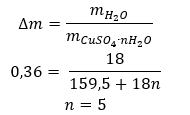
- Гідрат хлориду кобальту (II), CoCl 2 – безводний хлорид кобальту (II) високогігроскопічний. Завдяки сильній спорідненості з молекулами води він здатний поглинати вологу навіть з повітря. У результаті цього процесу утворюються гідрати цієї солі. Найбільш поширеною гідратованою формою є гексагідрат хлориду кобальту (II) – CoCl 2 * 6H 2. Іншою формою є молекула дигідрату. Ця сіль також демонструє здатність змінювати колір залежно від вмісту вологи. Безводна сіль блакитна, дигідрат набуває рожево-фіолетового кольору, а колір молекули гексагідрату інтенсивно червоний.
- Гідрат сульфату натрію (VI), Na 2 SO 4 – ця сіль існує у вигляді двох гідратів: гептагідрату (п’ять молекул води в структурі) і декагідрату (десять молекул води в структурі). Безводна форма сульфату натрію (VI) зустрічається в природі як рідкісний мінерал тенардит. Сульфат натрію десятигідрат (VI) — так звана глауберова сіль. Він широко використовується у виробництві скла, паперу, прального порошку та соди. Глауберова сіль також є одним з інгредієнтів, необхідних для виробництва синього пігменту ультрамарин. Крім того, з’єднання має лікувальну дію на травну систему, завдяки своїм проносним властивостям.

Гіпс
Прикладом неорганічного гідрату солі світового значення і широкого застосування є гіпс. Це мінерал, що складається з гідратованої форми сульфату кальцію (VI), CaSO 4 . Кристалічний гіпс є дигідратом цієї солі. У природних умовах він утворюється при випаровуванні солоної води з озер і річок при температурі нижче 42ᵒC. Безводний сульфат кальцію (VI) є ангідритом. Його також називають безводним гіпсом. З іншого боку, будівельним гіпсом є напівгідрат сульфату кальцію (VI). Яка форма цієї солі буде отримана, залежить від температури, що панує під час обробки материнської осадової породи. Гіпс, який використовується в будівництві, зазвичай є сумішшю різних форм солі гашеного вапна. 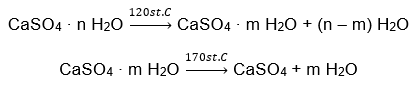
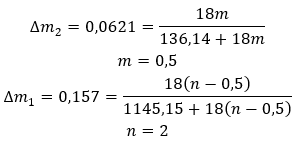 Можливості застосування гіпсу дуже широкі, особливо в будівельній галузі. Найважливіші способи використання цього гідрату солі перераховані нижче:
Можливості застосування гіпсу дуже широкі, особливо в будівельній галузі. Найважливіші способи використання цього гідрату солі перераховані нижче:
- У будівельній індустрії гіпс використовується в обробці елементів. Він є одним із компонентів сипучих напівфабрикатів, будівельних розчинів, клеїв, оздоблювальних матеріалів на основі гіпсу та готових монтажних компонентів, наприклад, гіпсокартону.
- Медицина використовує гіпс для накладання зламаних кінцівок. Гіпсові пов’язки вважаються приємними для шкіри. Крім того, матеріал також використовується в зуботехнічних лабораторіях.
- Промисловість використовує гіпс в модельних і дизайнерських майстернях. Гіпсові зліпки дуже добре підходять для формування різних предметів ужиткового призначення.
- Гіпс є добавкою до деяких добрив, що використовуються в сільському господарстві.

Клатрати метану
Клатрати метану належать до групи сполук, відомих як газогідрати. Вони відповідальні за більшість швидких змін клімату в історії Землі. Клатрати метану також часто називають гідратами метану або метановим льодом. Вони утворюють тверду форму води та метану . Їхні молекули відрізняються кристалічною будовою. Вони утворюються під підвищеним тиском. Вони мають форму білих твердих речовин без запаху, які за зовнішнім виглядом часто схожі на лід. Цікаво, що на дотик вони нагадують полістирол . Клатрати є унікальними хімічними угрупованнями . Молекули води утворюють структуру, що нагадує клітку. Усередині цієї клітки зберігається метан. Важливо, що ці дві речовини не утворюють хімічних зв’язків одна з одною. Як правило, клатрати метану складаються з 46 молекул води, що оточують дві малі та шість середніх клітин. Усередині них затримуються молекули метану. Також відомо, що клатрати складаються з 136 молекул води з 16 малими та вісьмома великими клітинами газу метану всередині. В останні роки значні обсяги цього ресурсу були виявлені на дні океанів. Він викликає великий інтерес через потенціал видобування значної кількості метану, який можна використовувати, наприклад, для енергетичних цілей. Клатрати метану горять рівномірним полум’ям червонуватого кольору. Після горіння залишається розплавлена вода. Видобутий таким чином метан може бути хорошою альтернативою звичайним джерелам вуглеводнів , але він також є серйозною загрозою для клімату. Досі недостатньо відомостей про використання метану з клатратів, накопичених на дні океану. Неконтрольований викид значної кількості цього газу може бути дуже небезпечним, оскільки він посилює парниковий ефект набагато сильніше, ніж вуглекислий газ.
