Дисоціація в хімічному контексті означає розкладання речовини на інші молекули. Слово походить від латинського терміну « dissociatio », що означає «відокремлення». У науковій номенклатурі дисоціація має різні визначення, як і своє специфічне значення в психології. Але давайте зосередимося на тому, що означає дисоціація в хімії. Залежно від перебігу процесу та використовуваної речовини можна виділити чотири різні типи дисоціації. Найпопулярнішим є електролітична дисоціація, хоча термічна дисоціація не менш важлива.

Термічна дисоціація
Процес полягає в розкладанні молекул на більш дрібні молекули або на атоми під впливом температури. Найважливішим зв’язком є той факт, що температура, яка використовується для дисоціації, може бути нижчою, якщо сполука містить слабкіші хімічні зв’язки. Ті, що мають більш високу енергію, необхідну для розкладання, вимагають більш високої температури. Поширеним прикладом термолізу (термічної дисоціації) є карамелізація сахарози, яка відбувається при 160 o C.
Електролітична дисоціація
Відкритий у 1887 році шведським хіміком Сванте Арреніусом, він є дещо складнішим порівняно з термічною дисоціацією. Електролітична дисоціація полягає в розкладанні речовини, яке відбувається при дії розчинника (зазвичай води) на вільно рухомі іони. У своїх дослідженнях Арреніус довів, що іони, які утворюються в результаті такої дисоціації, змушують розчин проводити електрику. Це стало основою для розробки класифікації хімічних речовин на електроліти (розчини, здатні проводити електричний струм) і неелектроліти (розчини, які не здатні проводити електричний струм).
Електроліти
Термін «електроліт» має два значення: з технічної точки зору це будь-яка речовина, здатна іонно переносити заряд між електродами. У результаті він може іонно проводити електричний струм. Інше, більш хімічне значення цього терміну відноситься до речовин, які піддаються електролітичній дисоціації внаслідок плавлення або розчинення. Такі розчини (найчастіше водні) також проводять електричний струм. Приклади таких електролітів включають іонні сполуки, такі як хлорид натрію (кухонна сіль), а також неіонні сполуки, наприклад , соляну кислоту або гідроксид калію . Електроліти за їх специфічними властивостями можна назвати електропровідниками. Їх можна розділити на провідники класу 1 (метали, їх сплави та вуглець) і провідники класу 2 (розчини основ, кислот і солей ).
Механізм електролітичної дисоціації
У розчиннику з високою діелектричною проникністю (наприклад, 81 для води) сили взаємного притягання між іонами в кристалічній сітці значно знижуються. Це коли іони відриваються, що змушує речовину розчинятися та виділяти вільно рухомі іони в розчин. Такі процеси також відбуваються за рахунок взаємодії іонів з молекулами води, що є наслідком полярної будови H 2 O. За Некрасовим, механізм дії води при розпаді електроліту з іонною структурою запускається позитивний іон речовини, який притягує протилежний полюс молекули води, водночас відштовхуючи позитивний іон. Протилежний полюс діє таким же чином, і обидва іони оточують молекули води, які вони притягнули. Таке тяжіння відбувається в обох напрямках між диполярними молекулами та іонами, що робить силу тяжіння іонів в електроліті значно меншою. Таким чином, механізм можна розділити на чотири основних етапи: перехід полярної структури в іонну, формування іонної структури і гідратація іонів. Зв’язки між іонами і розчинником, що утворюються в результаті дисоціації, називаються сольватами. Якщо розчинником є вода, то їх називають гідратами.
Гідратаційна оболонка
Це оболонка, що складається з молекул води, що знаходяться в найближчій близькості до іона, орієнтованих протилежними полюсами. Вільні, заряджені полюси притягують подальші шари води, поки сила тяжіння іонів не стане слабшою за енергію руху молекул у розчині. Оболонка сприяє розкладанню молекул електроліту на катіони та аніони та є бар’єром, який перешкоджає повторному зв’язуванню іонів з утворенням молекул. 
Дисоціація кислот і основ: закон дії мас
Сильні кислоти – це кислоти, які виявляють далекосяжну дисоціацію у водному розчині, а слабкі кислоти – це ті, які дисоціюють лише незначною мірою. Якщо ми порівнюємо силу різних кислот, ми також повинні взяти до уваги кілька факторів, таких як схильність молекул кислоти віддавати свої протони або концентрацію відповідної речовини. Але є хімічна величина, яка не залежить від концентрації, але чудово характеризує індивідуальні властивості молекул – константа дисоціації. Отримання рівняння для цього значення слід розпочати з написання рівняння для кислотної дисоціації . Для прикладу з одним протоном (HX) це виглядатиме так: ![]() Якщо розчин розбавлений, а кислота слабка, можна застосувати закон дії мас, який виражається наступним чином:
Якщо розчин розбавлений, а кислота слабка, можна застосувати закон дії мас, який виражається наступним чином: 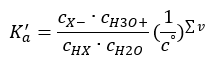 Є два способи скоротити представлені відносини. Першим кроком є припущення, що концентрація води постійна. Ми також можемо опустити символ c o , оскільки він виражає стандартну концентрацію, що дорівнює 1 моль/дм 3 . Однак важливо помістити його в початкову формулу і врахувати при визначенні одиниці. Це тому, що хімічні константи є безрозмірними величинами. При цьому всі концентрації, які використовуються у формулі, виражені в моль/дм 3 . Тоді ми остаточно отримуємо формулу для константи дисоціації:
Є два способи скоротити представлені відносини. Першим кроком є припущення, що концентрація води постійна. Ми також можемо опустити символ c o , оскільки він виражає стандартну концентрацію, що дорівнює 1 моль/дм 3 . Однак важливо помістити його в початкову формулу і врахувати при визначенні одиниці. Це тому, що хімічні константи є безрозмірними величинами. При цьому всі концентрації, які використовуються у формулі, виражені в моль/дм 3 . Тоді ми остаточно отримуємо формулу для константи дисоціації: 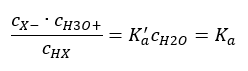 Співвідношення, що виражає константу кислотної дисоціації (K a ), складається з значень, визначених експериментом, які знаходяться в діапазоні від 10 -10 до 10 8 . Популярною операцією є використання логарифмічної формули, вираженої як від’ємний логарифм константи дисоціації, позначеної як pK a : pK a = -logK a. Важливо, що низькі значення K a представляють слабкі кислоти, а високі значення представляють сильні кислоти. , pK a змінюється протилежним чином. Низькі, зазвичай негативні значення pK a відповідають сильним кислотам. Позитивні високі значення pK a представляють слабкі кислоти. Коли ми вводимо інше поняття, ступінь дисоціації (α), яка є відношенням числа молей молекул даної сполуки, які піддаються дисоціації (розпаду на іони), до загальної кількості молей молекул цієї сполуки, присутньої в розчині, ми можемо далі розвинути рівняння. Якщо ми знехтуємо дуже низькою концентрацією іонів водню, що утворюються в результаті дисоціації води, і використовуємо рівноважні концентрації іонів і молекул, ми можемо припустити, що:
Співвідношення, що виражає константу кислотної дисоціації (K a ), складається з значень, визначених експериментом, які знаходяться в діапазоні від 10 -10 до 10 8 . Популярною операцією є використання логарифмічної формули, вираженої як від’ємний логарифм константи дисоціації, позначеної як pK a : pK a = -logK a. Важливо, що низькі значення K a представляють слабкі кислоти, а високі значення представляють сильні кислоти. , pK a змінюється протилежним чином. Низькі, зазвичай негативні значення pK a відповідають сильним кислотам. Позитивні високі значення pK a представляють слабкі кислоти. Коли ми вводимо інше поняття, ступінь дисоціації (α), яка є відношенням числа молей молекул даної сполуки, які піддаються дисоціації (розпаду на іони), до загальної кількості молей молекул цієї сполуки, присутньої в розчині, ми можемо далі розвинути рівняння. Якщо ми знехтуємо дуже низькою концентрацією іонів водню, що утворюються в результаті дисоціації води, і використовуємо рівноважні концентрації іонів і молекул, ми можемо припустити, що: 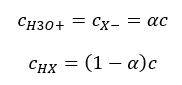 Тоді константу дисоціації можна позначити наступним чином:
Тоді константу дисоціації можна позначити наступним чином:  У такому вигляді це залежність ступеня дисоціації електроліту від його концентрації, тобто закон розведення Оствальда. Якщо ми аналізуємо дуже слабкі електроліти, ступінь дисоціації (α) можна вважати <<1, і формулу можна спростити до наступного:
У такому вигляді це залежність ступеня дисоціації електроліту від його концентрації, тобто закон розведення Оствальда. Якщо ми аналізуємо дуже слабкі електроліти, ступінь дисоціації (α) можна вважати <<1, і формулу можна спростити до наступного:  Кислоти, які містять більше одного протона, піддаються багатоступінчастій дисоціації, і ми повинні враховувати всі її стадії. Для прикладу ортофосфорна кислота має три стадії:
Кислоти, які містять більше одного протона, піддаються багатоступінчастій дисоціації, і ми повинні враховувати всі її стадії. Для прикладу ортофосфорна кислота має три стадії:
- H 3 PO 4 + H 2 O = H 2 PO 4 – + H 3 O +
- H 2 PO 4 – + H 2 O = HPO 4 2- + H 3 O +
- HPO 4 2- + H 2 O = PO 4 3- + H 3 O +
Кожна стадія має свою константу рівноваги, яку можна позначити аналогічно першій:  Константи дисоціації наведено в таблиці як для гідрацидів, так і для оксикислот.
Константи дисоціації наведено в таблиці як для гідрацидів, так і для оксикислот.
| Кислота | К а | pK a |
| HF | 6,3·10 -4 | 3.2 |
| HCl | 1·10 7 | -7 |
| HNO 3 | 27.54 | -1,44 |
| H 3 PO 4 | 6,9·10 -3 | 2.16 |
Таблиця 1. Приклади значень констант дисоціації для кислот. Аналогічно і для стабілізації рівноваги основ при дисоціації. Розглядаючи приклад правила B, рівняння можна зазначити таким чином: ![]() Тоді, якщо ми хочемо отримати константу дисоціації для основи, використовуючи закон дії мас і припускаючи, що концентрація води в розбавленому розчині фактично стала, ми отримаємо таку формулу:
Тоді, якщо ми хочемо отримати константу дисоціації для основи, використовуючи закон дії мас і припускаючи, що концентрація води в розбавленому розчині фактично стала, ми отримаємо таку формулу:  Чим сильніша основа, тим вища константа дисоціації та нижче значення pK b , тоді як чим нижча константа дисоціації та вище значення pK b , тим слабша основа.
Чим сильніша основа, тим вища константа дисоціації та нижче значення pK b , тоді як чим нижча константа дисоціації та вище значення pK b , тим слабша основа.
| База | К б | pK b |
| Гідразин | 3·10 -6 | 5.5 |
| Аміак | 1,78·10 -5 | 4.75 |
| Метиламін | 5,0·10 -4 | 3.3 |
Таблиця 2. Приклади значень констант дисоціації основ. 
Від чого залежить сила кислот
Якщо ми знаємо вирази констант дисоціації для конкретних кислот, ми можемо зробити кілька вірних припущень:
- Сила гідрациду зростає разом із збільшенням атомного номера елемента, пов’язаного з атомом водню.
- Сила гідрациду знижується разом із збільшенням електронегативності елемента, приєднаного до атома водню. Це може вводити в оману, оскільки теоретично зростання електронегативності має сприяти абстракції протонів.
- Розмір утвореного при дисоціації аніона впливає на константу дисоціації більшою мірою, ніж електронегативність.
Самодисоціація води
Цікавим прикладом дисоціації є розпад молекул води. Оскільки вони здатні як притягувати протони, так і віддавати їх, чиста вода зазнає незначної самодисоціації згідно з наступним рівнянням: H 2 O + H 2 O ↔ H 3 O + + OH – Як для кислот і основ, також можна застосувати закон дії мас, який включає рівноважні концентрації недисоційованої води, а також її аніонів і катіонів: 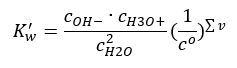 Виявляється, концентрації катіонів H 3 O + і аніонів OH – настільки малі порівняно з недисоційованою водою, що навіть їх зміна практично не змінює концентрацію недисоційованої води. Це дає змогу вважати це значення постійним і перетворити рівняння до такої форми: K w = c OH – · c H3O + Це особливо важливий аспект у контексті хімічних обчислень, і така константа називається як іонний продукт води. Він також часто використовується як від’ємний логарифм, позначається як pK w . Це дорівнює –logK w . Виходячи з рівняння, якщо іонна рівновага води порушується в результаті надходження іонів H 3 O + , то для підтримки постійності іонного добутку необхідно зменшити концентрацію іонів OH – . Так само надлишок іонів ОН – знижує концентрацію катіонів. Добуток цих концентрацій має бути постійним. Досліди показали, що K w при температурі 298 К становить 10 -14 . Таким чином, ми також можемо помітити рівняння, справедливе для чистої води:
Виявляється, концентрації катіонів H 3 O + і аніонів OH – настільки малі порівняно з недисоційованою водою, що навіть їх зміна практично не змінює концентрацію недисоційованої води. Це дає змогу вважати це значення постійним і перетворити рівняння до такої форми: K w = c OH – · c H3O + Це особливо важливий аспект у контексті хімічних обчислень, і така константа називається як іонний продукт води. Він також часто використовується як від’ємний логарифм, позначається як pK w . Це дорівнює –logK w . Виходячи з рівняння, якщо іонна рівновага води порушується в результаті надходження іонів H 3 O + , то для підтримки постійності іонного добутку необхідно зменшити концентрацію іонів OH – . Так само надлишок іонів ОН – знижує концентрацію катіонів. Добуток цих концентрацій має бути постійним. Досліди показали, що K w при температурі 298 К становить 10 -14 . Таким чином, ми також можемо помітити рівняння, справедливе для чистої води:  Дисоціація також пов’язана зі значенням рН розчину. Розчини з рівними концентраціями катіонів H 3 O + і аніонів OH – демонструють нейтральний pH. У кислих розчинах концентрація катіонів вище 10 -7 моль/л, а в лужних — нижче 10 -7 моль/л.
Дисоціація також пов’язана зі значенням рН розчину. Розчини з рівними концентраціями катіонів H 3 O + і аніонів OH – демонструють нейтральний pH. У кислих розчинах концентрація катіонів вище 10 -7 моль/л, а в лужних — нижче 10 -7 моль/л.
