Розчином вважається однорідна суміш не менше двох речовин. Хоча ми розглядаємо розчин переважно як рідину, газоподібні та тверді суміші також є розчинами. Тим не менш, дуже велика група хімічних реакцій, як в лабораторних, так і в промислових масштабах, відбувається у водному середовищі. Є три типи рідких розчинів: розчинник завжди рідкий, але розчинена речовина може бути газом, рідиною або твердою речовиною. Серед прикладів – водні розчини хлористого водню, етанолу та кухонної солі.

Опис складу розчину
Найважливішою ознакою будь-якого розчину є визначення його складу. Уміння визначати склад розчину і перераховувати його залежно від одиниць, що представляють інтерес, є базовим умінням кожного хіміка. Кількість даного інгредієнта в суміші можна визначити різними способами, наприклад, масою, об’ємом або молярністю. З цієї причини також існує кілька типів концентрацій, що визначають залежність кількості компонента від кількості розчину або суміш. Найчастіше, описуючи склад розчинів, ми використовуємо терміни: масова частка, об’ємна частка, молярна частка та молярна концентрація. Дроби вказують, яку частину даної суміші становить інгредієнт, що цікавить. Вони можуть бути виражені в одиницях маси, об’єму або молях сполуки.
Молярна концентрація
Це найбільш часто вибирається концентрація, що пояснюється зручністю використання шляхом визначення кількості молей речовини, що міститься в об’ємі розчину. Теоретичною основою є твердження про те, що розчини двох різних речовин однакової концентрації та об’єму при однаковій температурі містять однакову кількість молей, а отже, однакову кількість молекул розчиненої речовини. На основі цього співвідношення для розчинів з рівними молярними концентраціями можна змішувати відповідні об’єми розчинів для досягнення правильної пропорції кількості молей, визначеної стехіометричними коефіцієнтами. Це означає, що якщо говорити про реакції типу A + B → C, де один моль речовини A реагує з одним молем речовини B, то для того, щоб реакція пройшла повністю, необхідно змішати рівні об’єми обох розчинів з однаковою молярною концентрацією. . У разі реакції типу A + 2B → C, тобто один моль речовини A реагує з двома молями речовини B, один об’єм розчину A слід змішати з двома об’ємами розчину B. У цьому випадку існує також інший розчину, оскільки замість використання еквімолярних розчинів в об’ємному співвідношенні 1:2 можна використовувати один об’єм розчину А та один об’єм розчину В подвоєної концентрації. Молярна концентрація, що позначається C m , визначає кількість молей речовини, що міститься в одиниці об’єму, найчастіше в 1 дм 3 розчину. Формула, за якою можна розрахувати молярну концентрацію, є часткою числа молей речовини (n s ) і загального об’єму розчину (V зол ) в дм 3 : 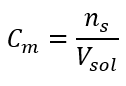 Використовуючи основну одиницю об’єму за системою СІ, тобто кубічний метр, як одиницю кількості речовини слід використовувати кіломоль. Однак це не є великою обчислювальною проблемою, оскільки
Використовуючи основну одиницю об’єму за системою СІ, тобто кубічний метр, як одиницю кількості речовини слід використовувати кіломоль. Однак це не є великою обчислювальною проблемою, оскільки 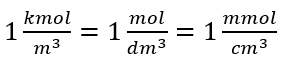 . Одиниця молярної концентрації C m визначається як моль на кубічний дециметр, часто позначається як M. 1 моль/дм 3 = 1M
. Одиниця молярної концентрації C m визначається як моль на кубічний дециметр, часто позначається як M. 1 моль/дм 3 = 1M 
Використання молярної концентрації
а) Розрахунок молярної концентрації за вмістом компонента в розчині. Приклад 1. Розчин містить 30 г калій гідроксиду в 3,0 дм 3 розчину. Обчисліть його молярну концентрацію. Крок 1. Розрахунок молярної маси КОН 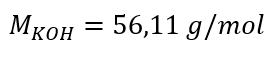 Крок 2. Розрахунок кількості молей КОН у розчині
Крок 2. Розрахунок кількості молей КОН у розчині 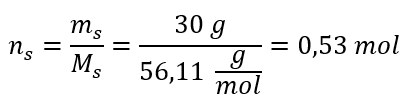 Крок 3. Розрахунок молярної концентрації за формулою
Крок 3. Розрахунок молярної концентрації за формулою 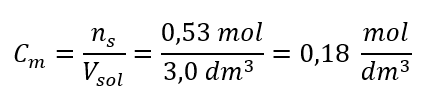 Відповідь: молярна концентрація розчину гідроксиду калію, що містить 30 г речовини в 3,0 дм 3 розчину, дорівнює C m =
Відповідь: молярна концентрація розчину гідроксиду калію, що містить 30 г речовини в 3,0 дм 3 розчину, дорівнює C m = 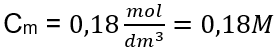 б) Приготування розчину заданої концентрації. Приклад 2. Обчисліть масу глюкози (C 6 H 12 O 6 ), необхідну для приготування 300 см 3 розчину концентрацією 0,32 моль/дм 3 . Крок 1. Розрахунок молярної маси глюкози
б) Приготування розчину заданої концентрації. Приклад 2. Обчисліть масу глюкози (C 6 H 12 O 6 ), необхідну для приготування 300 см 3 розчину концентрацією 0,32 моль/дм 3 . Крок 1. Розрахунок молярної маси глюкози 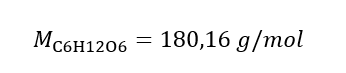 Крок 2. Розрахунок необхідної маси глюкози, використовуючи перетворену молярну формулу, знаючи це
Крок 2. Розрахунок необхідної маси глюкози, використовуючи перетворену молярну формулу, знаючи це 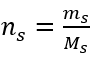 :
: 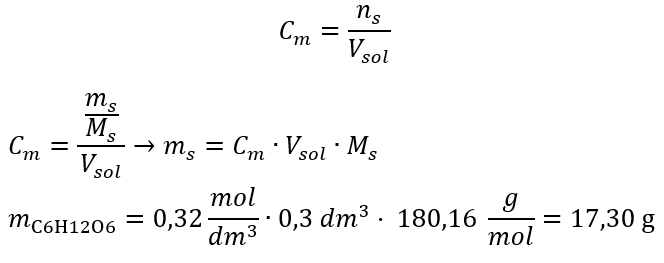 Після цих розрахунків ми знаємо, що для приготування такого розчину необхідно зважити 17,30 г глюкози і кількісно перенести її в мірну колбу місткістю 300 см 3 . Відповідь: для приготування 300 см 3 розчину глюкози з молярною концентрацією 0,32 моль/дм 3 необхідно зважити 17,30 г речовини. c) Розведення та концентрація концентрованих розчинів Використовуючи молярну концентрацію, ми також можемо приготувати розчин заданої концентрації (C m2 ) шляхом розведення концентрованого розчину (C m1 ), де:
Після цих розрахунків ми знаємо, що для приготування такого розчину необхідно зважити 17,30 г глюкози і кількісно перенести її в мірну колбу місткістю 300 см 3 . Відповідь: для приготування 300 см 3 розчину глюкози з молярною концентрацією 0,32 моль/дм 3 необхідно зважити 17,30 г речовини. c) Розведення та концентрація концентрованих розчинів Використовуючи молярну концентрацію, ми також можемо приготувати розчин заданої концентрації (C m2 ) шляхом розведення концентрованого розчину (C m1 ), де: 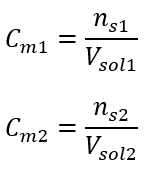 Під час розведення змінюється лише об’єм розчину, кількість молей розчиненої речовини залишається незмінною. Отже, можна припустити, що:
Під час розведення змінюється лише об’єм розчину, кількість молей розчиненої речовини залишається незмінною. Отже, можна припустити, що: ![]() Перетворивши формулу для молярної концентрації, отримаємо такі співвідношення:
Перетворивши формулу для молярної концентрації, отримаємо такі співвідношення: 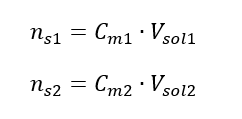 Знаючи, що ми отримуємо рівняння:
Знаючи, що ми отримуємо рівняння: 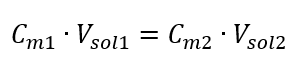 Формула для розведення розчинів з урахуванням молярної концентрації, включаючи новоотриману (C mx ), може бути записана як:
Формула для розведення розчинів з урахуванням молярної концентрації, включаючи новоотриману (C mx ), може бути записана як: 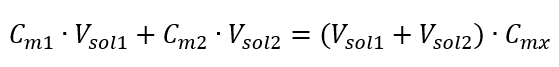 Приклад 3. Який об’єм кислоти масою 0,150 моль/дм 3 можна отримати, розбавивши водою 250 см 3 розчину цієї кислоти концентрацією 0,750 моль/дм 3 ? Крок 1. Перетворення формули в припущенні, що концентрація води C m2 = 0 моль/дм 3 .
Приклад 3. Який об’єм кислоти масою 0,150 моль/дм 3 можна отримати, розбавивши водою 250 см 3 розчину цієї кислоти концентрацією 0,750 моль/дм 3 ? Крок 1. Перетворення формули в припущенні, що концентрація води C m2 = 0 моль/дм 3 . 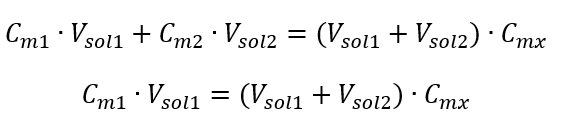 Крок 2. Розрахунок загального об’єму (V x )
Крок 2. Розрахунок загального об’єму (V x ) 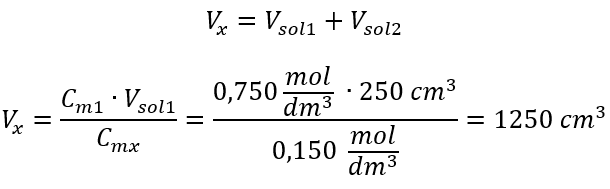 В якості альтернативи можна використовувати співвідношення постійності кількості молей під час розведення:
В якості альтернативи можна використовувати співвідношення постійності кількості молей під час розведення: 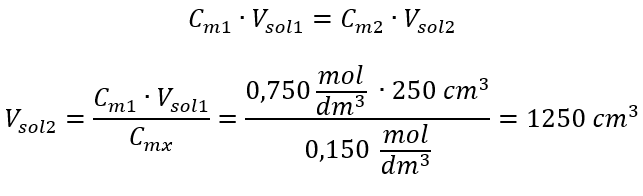 Відповідь: Для розведення кислоти до потрібної концентрації необхідно витратити 1,25 дм 3 води. Приклад 4. Обчисліть, скільки води необхідно випарувати з 300 см 3 розчину концентрацією 0,125 моль/дм 3 , щоб отримати розчин концентрацією 1,50 моль/дм 3 . Крок 1. Перетворення формули для зміни молярної концентрації в припущенні, що молярна концентрація води C m2 = 0 моль/дм 3 .
Відповідь: Для розведення кислоти до потрібної концентрації необхідно витратити 1,25 дм 3 води. Приклад 4. Обчисліть, скільки води необхідно випарувати з 300 см 3 розчину концентрацією 0,125 моль/дм 3 , щоб отримати розчин концентрацією 1,50 моль/дм 3 . Крок 1. Перетворення формули для зміни молярної концентрації в припущенні, що молярна концентрація води C m2 = 0 моль/дм 3 . 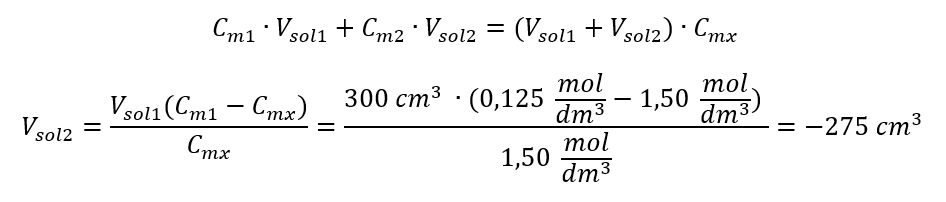 Відповідь: Щоб сконцентрувати розчин, потрібно випарувати 275. Перетворення молярної концентрації у відсоткову концентрацію У повсякденній лабораторній роботі необхідно конвертувати різні концентрації розчинів. Найчастіше використовують молярну концентрацію та процентну концентрацію. Перемикатися між ними можна за допомогою густоти розчину. Цей параметр необхідно ввести у формули концентрацій, що цікавлять:
Відповідь: Щоб сконцентрувати розчин, потрібно випарувати 275. Перетворення молярної концентрації у відсоткову концентрацію У повсякденній лабораторній роботі необхідно конвертувати різні концентрації розчинів. Найчастіше використовують молярну концентрацію та процентну концентрацію. Перемикатися між ними можна за допомогою густоти розчину. Цей параметр необхідно ввести у формули концентрацій, що цікавлять: 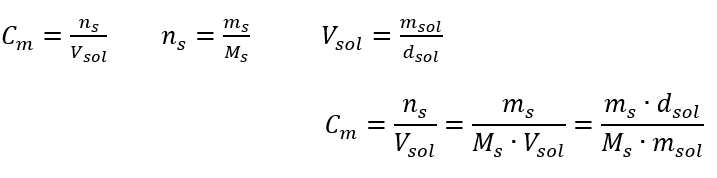 При перетворенні ми бачимо відношення маси речовини до маси розчину, яке є основою відсоткової концентрації, виражене формулою:
При перетворенні ми бачимо відношення маси речовини до маси розчину, яке є основою відсоткової концентрації, виражене формулою: 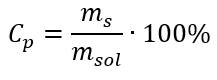 Підставляючи формулу для процентної концентрації в попередньо перетворену формулу для молярної концентрації, ми отримуємо співвідношення, яке дозволяє вільно перемикатися між двома значеннями:
Підставляючи формулу для процентної концентрації в попередньо перетворену формулу для молярної концентрації, ми отримуємо співвідношення, яке дозволяє вільно перемикатися між двома значеннями: 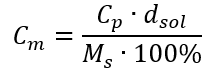 Єдиним обмеженням формули є використання відповідних одиниць, тому їх варто враховувати в усіх розрахунках. Приклад 5. Обчисліть молярну концентрацію сульфатної (VI) кислоти, знаючи, що її відсоткова концентрація C p = 98,0 %, а густина d = 1,84 кг/дм 3 . Це можна розрахувати за допомогою двох методів: Метод 1. У декілька кроків, без використання формули Крок 1. Розрахунок маси 1,00 дм 3 кислоти
Єдиним обмеженням формули є використання відповідних одиниць, тому їх варто враховувати в усіх розрахунках. Приклад 5. Обчисліть молярну концентрацію сульфатної (VI) кислоти, знаючи, що її відсоткова концентрація C p = 98,0 %, а густина d = 1,84 кг/дм 3 . Це можна розрахувати за допомогою двох методів: Метод 1. У декілька кроків, без використання формули Крок 1. Розрахунок маси 1,00 дм 3 кислоти 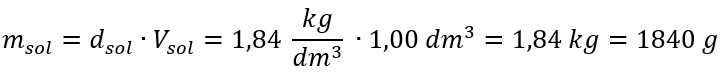 Крок 2. Розрахунок маси кислоти з урахуванням відсоткової концентрації
Крок 2. Розрахунок маси кислоти з урахуванням відсоткової концентрації 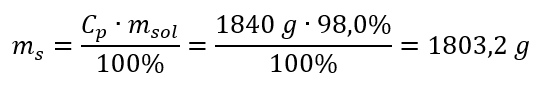 Крок 3. Розрахунок кількості молей
Крок 3. Розрахунок кількості молей 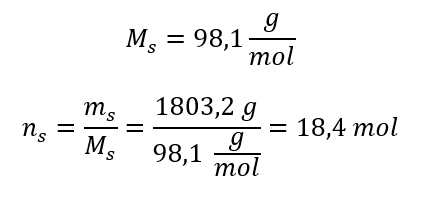 Крок 4. Розрахунок молярної концентрації, знаючи, що це кількість молей речовини в 1 дм 3 розчину.
Крок 4. Розрахунок молярної концентрації, знаючи, що це кількість молей речовини в 1 дм 3 розчину. 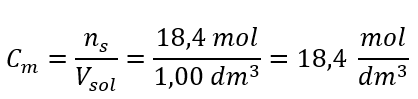 Спосіб 2. Використання співвідношення між відсотковою концентрацією та молярною концентрацією
Спосіб 2. Використання співвідношення між відсотковою концентрацією та молярною концентрацією 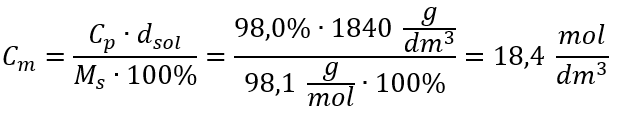 Відповідь: молярна концентрація цієї кислоти 18,4 моль/дм 3 .
Відповідь: молярна концентрація цієї кислоти 18,4 моль/дм 3 .
