Це група неорганічних сполук, утворених з'єднанням різних елементів з киснем. Їх загальна формула X n O m , де «Х» — будь-який елемент, «О» — кисень, завжди в другому ступені окислення, а літери «n,m» у нижньому індексі — коефіцієнти. Приклади оксидів: вода H 2 O, калій оксид K 2 O, алюміній оксид Al 2 O 3 , кальцій оксид CaO і карбон (II) монооксид CO.

Класифікація оксидів
Оксиди можна розділити на кілька категорій. Найбільш загальною класифікацією є відмінність між оксидами металів, наприклад оксидом літію, оксидом магнію, оксидом алюмінію, оксидом заліза, і оксидами неметалів, включаючи оксид вуглецю, оксид азоту, оксид сірки та оксид хлору . Іншим критерієм є класифікація за фізичним станом. Майже всі оксиди металів і деякі неметали (SiO 2 , P 4 O 10 ) — тверді речовини. Вода, сульфур (VI) оксид і манган (VII) оксид — рідини. Оксиди неметалів, такі як CO, CO 2 , SO 2 , NO i NO 2 є газами. Оксиди також можна класифікувати за типом зв’язків, що в них виникають. Оксид магнію MgO, оксид кальцію CaO або оксид натрію Na 2 O містять іони O 2- та іонні зв’язки, звідки і їх назва – іонні оксиди. Іншу групу складають ковалентні оксиди, наприклад карбон (II) оксид CO, азот (II) оксид NO або сульфур (IV) оксид SO 2 , у яких зв’язок між атомом кисню та елементом має форму полярного ковалентного зв’язку.
Хімічна природа оксидів
Для хіміків найцікавіша класифікація, заснована на хімічній природі оксидів. Існує чотири основні категорії оксидів – кислотні, основні, нейтральні та амфотерні.
- Кислотні оксиди , іноді також звані ангідридами кислот, відрізняються тим, що вони реагують з лугами з утворенням солі. Значна частина кислотних оксидів після розчинення у воді утворює відповідні розчини оксикислот . Це стосується, наприклад, оксиду сірки (IV), який при розчиненні у воді утворює сірчану (IV) кислоту , і оксиду хрому (VI), який розчиняється в хромову (VI) кислоту:
SO 2 + H 2 O → H 2 SO 3 CrO 3 + H 2 O → H 2 CrO 4 Існує невелика група кислотних оксидів, нерозчинних у воді. Однак вони розчиняються в розчинах сильних лугів , наприклад кремнію ( IV) оксид SiO 2 , молібден (VI) оксид MoO 3 і вольфрам (VI) оксид WO 3 . Їх реакції з лугами підтверджують їх кислотний характер: SiO 2 + 2NaOH → Na 2 SiO 3 + H 2 O MoO 3 + 2KOH → K 2 MoO 4 + H 2 O WO 3 + 2NaOH → Na 2 WO 4 + H 2 O Як Як правило, кислотні оксиди — це оксиди неметалів і оксиди металів у найвищих можливих ступенях окислення. Якщо даний елемент утворює кілька оксидів з різними ступенями окиснення, як, наприклад, хром, то кислотні властивості його оксидів зростають зі збільшенням ступеня окиснення:
- хром (II) CrO оксид лужний,
- хром (III) оксид Cr 2 O 3 має амфотерні властивості,
- хром (VI) оксид CrO 3 є кислим.

- Лужні оксиди – це такі сполуки кисню з металами, які реагують з кислотами з утворенням відповідних солей. Деякі з них, тобто оксиди елементів першої та другої групи таблиці Менделєєва, за винятком берилію, також характеризуються реакцією з водою з утворенням лужних гідроксидів. Це відбувається, наприклад, під час реакції оксиду натрію, оксиду літію та оксиду барію з водою:
Na 2 O + H 2 O → 2NaOH Li 2 O + H 2 O → 2LiOH BaO + H 2 O → Ba(OH) 2 Існують також лужні оксиди, які розчиняються не у воді, а тільки в кислотних розчинах. До них належать, наприклад, оксид марганцю (II) і оксид заліза (II): MnO + H 2 SO 4 → MnSO 4 + H 2 O FeO + 2HCl → FeCl 2 + H 2 O
- Найменш реакційноздатною групою оксидів є нейтральні оксиди . Вони не реагують ні з кислотами, ні з лугами. Вони також нерозчинні у воді. Прикладами цієї групи оксидів є карбон (II) оксид CO і азот (II) оксид NO.
- Амфотерні оксиди є повною протилежністю нейтральних оксидів і водночас є і кислотними, і лужними. Це означає, що вони реагують як з сильними лугами, так і з кислотами. Продуктами цих реакцій завжди є солі, а елемент, який спочатку з’єднується з киснем, перетворюється на відповідний катіон або аніон кислотного залишку. Єдиною схожістю з нейтральними оксидами є їх погана розчинність у воді. Прикладами амфотерних оксидів є: берилій оксид BeO, алюміній оксид Al 2 O 3 , хром (III) оксид, станин (II) оксид SnO, свинцю (II) оксид PbO, цинк оксид ZnO. Реагуючи з водними розчинами сильних лугів, наприклад з водним розчином гідроксиду натрію , вони утворюють комплексні солі . У їх кислотних залишках атоми або іони металу, який утворюється з оксиду, присутні в комплексах з відповідною кількістю гідроксильних груп. Їх кількість залежить від координаційного числа даного елемента. Наприклад, атоми, похідні від оксидів MO (M – метал), такі як оксид берилію BeO, мають координаційне число 4. Атоми, похідні від оксидів типу M 2 O 3 , наприклад Al 2 O 3 , можуть мати два різних координаційних числа і залежно від умов реакції 4 або 6. Приклади реакцій амфотерних оксидів:
BeO + 2HCl → BeCl 2 + H 2 O BeO + 2NaOH + H 2 O → Na 2 [Be (OH) 4] тетрагідроксицинкат натрію Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O Al 2 O 3 + 2KOH + 3H 2 O → 2K[Al (OH) 4] тетрагідроксиалюмінат калію Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 [Al (OH) 6] гексагідроксіалюмінат натрію Деякі оксиди , такі як оксид цинку та оксид мангану (IV), мають досить специфічні амфотерні властивості. Останній ні в нормальних, ні в стандартних умовах не реагує з лугами. Обидва, з іншого боку, реагують з ними шляхом сплавлення з твердими лугами, наприклад: 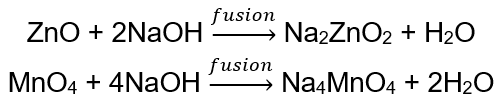

Отримання оксидів
- Прямий синтез елементів: а) синтез атомів Сульфуру та атомів Оксигену з утворенням сульфур (IV) оксиду S + O → SO 2 б) синтез атомів Магнію та атомів Оксигену з утворенням магній оксиду 2Mg + O 2 → 2MgO. в) синтез атомів Карбону та атомів Оксигену з утворенням карбон (IV) монооксиду C + O 2 → CO 2
- Термічний розклад солей , гідроксидів і оксидів: а) розклад кальцій карбонату на кальцій оксид і карбон (IV) монооксид CaCO 3 → CaO + CO 2 б) розклад купрум (II) гідроксиду на купрум (II) оксид і воду Cu( OH) 2 → CuO + H 2 O в) розклад манган (IV) оксиду на манган (III) оксид і кисень 4MnO 2 → 2Mn 2 O 3 + O 2
- Окиснення оксидів при нижчих ступенях окиснення зі збільшенням їх валентності: а) окислення сульфур (IV) оксиду до сульфур (VI) оксиду 2SO 2 + O 2 → 2SO 3 б) окислення нітро (II) оксиду до нітрат ( IV) оксид 2NO + O 2 → 2NO 2 в) окиснення карбон (II) оксиду до карбон (IV) оксиду (IV) 2CO + O 2 → 2CO 2
- Відновлення оксидів у вищих ступенях окиснення зі зменшенням їх валентності: а) відновлення карбон (IV) монооксиду до карбон (II) монооксиду (II) CO 2 + C → 2CO б) відновлення станин (II) оксиду до олова (I) оксид 2SnO + O 2 → 2SnO 2
- Горіння органічних сполук: а) спалювання метану в кисні з утворенням карбон (IV) оксиду і води CH 4 + 2O 2 → CO 2 + 2H 2 O б) спалювання аміаку в кисні з одержанням азоту (II) оксиду і вода 4NH 3 + 5O 2 → 4NO + 6H 2 O
- Реакція нестійких оксикислот: а) розклад карбонатної (IV) кислоти на карбон (IV) оксид і воду: H 2 CO 3 → CO 2 + H 2 O б) розклад сульфатної (IV) кислоти на сульфур (IV) оксид і вода: H 2 SO 3 → SO 2 + H 2 O

