За визначенням, хімічна активність — це здатність елемента віддавати електрони в хімічних реакціях. На практиці їхня активність зростає зі зменшенням електронегативності - показника здатності елемента притягувати електрони. Якщо метал не притягує сильно електрони, він більш реакційноздатний. Елемент відліку, водень, використовується для класифікації хімічної активності металів. Мірою активності металу є його здатність витісняти водень із кислот або водень із молекули води.

Ряд хімічної активності металів
Цей термін використовується для опису хімічних елементів, які є металевими за своєю природою , у певному порядку від найменшої до найбільш хімічно активної. Це використовується для порівняння активності різних металів. Крім металів, ряд хімічної активності також включає один неметал, водень , який є еталонним елементом. Чим вище в ряду активності знаходиться метал, тим він реакційноздатніший . Це також пов’язано з тим фактом, що він легше окислюється і тому є сильнішим відновником і хімічно активнішим елементом. Навпаки, чим нижче в ряду активності розташований метал, тим менш він реакційноздатний. Це означає, що він легше піддається реакції відновлення і тому є сильнішим окислювачем, менш активним елементом. Використовуючи значення, наведені в таблиці 1, ми можемо побачити, що чим нижче значення стандартного потенціалу елемента, тим сильніший відновник і тим хімічно активніший метал. Мірою здатності віддавати електрони в ряді активностей металів є їхнє стандартне потенційне значення . Для водню, а точніше водневого електрода, стандартний потенціал приймається рівним нулю. Стандартний потенціал – це електрорушійна сила комірки, що складається зі стандартної водневої напівелементу та іншої напівелементу, в якій концентрації субстратів і продуктів становлять 1 моль/дм 3 .
| Електрод | Стандартний потенціал [V] |
| Li/Li + | -3.04 |
| Ca/Ca 2+ | -2,86 |
| Mg/Mg 3+ | -2,36 |
| Al/Al 3+ | -1,69 |
| Mn/Mn 2+ | -1,18 |
| Zn/Zn 2+ | -0,76 |
| Cr/Cr 3+ | -0,74 |
| Fe/Fe 2+ | -0,44 |
| CD/CD 2+ | -0,40 |
| Ко/Ко 2+ | -0,28 |
| Ni/Ni 2+ | -0,26 |
| Sn/Sn 2+ | -0,14 |
| Pb/Pb 2+ | -0,14 |
| Fe/Fe 3+ | 0,04 |
| H 2 /2H + | 0,00 |
| Бі/Бі 3+ | +0,32 |
| Cu/Cu 2+ | +0,34 |
| Ag/Ag + | +0,80 |
| Hg/Hg 2+ | +0,85 |
| Au/Au 3+ | +1,52 |
Таблиця 1 . Електрохімічний ряд металів Найактивніші метали, видимі у верхній частині ряду. Ті, що знаходяться вище водню, легко окислюються і тому є сильнішими відновниками, ніж водень. Елементи нижче водню в серії легше відновлюються і є сильнішими окислювачами. Якщо метал має більш негативний потенціал, ніж інший, це означає, що він витіснить його з його солі. Наприклад, залізо витіснить мідь у солях міді, але мідь не витіснить залізо з його солей. Натомість він може витіснити срібло із солей срібла. Літій і берилій з розчинів солей інших металів не витісняють їх, а реагують безпосередньо з водою. Вони витісняють водень і утворюють свої сполуки – гідроксиди . Такі метали називають активними металами. Активність металів і періодична система елементів Як і багато інших властивостей, хімічну активність елемента можна визначити за його положенням у періодичній системі . Найактивнішими є метали I і II груп, які легко витісняють водень з води з утворенням гідроксидів. У групі хімічна активність металів зростає зі збільшенням атомного номера . Період зменшується зі збільшенням атомного номера. 
Дорогоцінні та недорогоцінні метали
Водень не тільки забезпечує точку відліку активності, але також розділяє дорогоцінні та недорогоцінні метали в серії . Неблагородні метали – це ті, що вище водню. Кожен реагує з кислотами, витісняючи з них водень. Від калію до кальцію вони реагують з водою вже при кімнатній температурі, а від магнію до заліза — при підвищеній температурі. Усі метали, які в ряду активності стоять нижче водню , не витісняють водень із кислот . Однак вони можуть реагувати з кислотами-окислювачами з утворенням відповідних солей і оксидів , які утворюються при відновленні кислотного залишку. Елементи в нижній частині серії, від срібла до золота, настільки стійкі до хімічних реакцій, що реагують лише з царською горілкою . Таким розчином є суміш концентрованого розчину хлоридної кислоти і концентрованого розчину нітратної кислоти (V) , змішаних в об’ємному співвідношенні 3:1. Знаючи ці факти, ми можемо зробити висновок, що для визначення активності елемента можна провести декілька реакцій: з водою кімнатної температури, з гарячою водою, з неокислювальною кислотою, з окислювальною кислотою та з царською горілкою.
Експеримент з виявлення металів, які витісняють водень із кислот
Найпростіший спосіб підтвердити активність металу – це провести експеримент. Для цього необхідно підготувати десять пробірок, в які по 1-5 поміщають послідовно: магнієву стрічку, цинковий дріт, залізний дріт, нікелевий дріт і мідний дріт. Такий же порядок слід повторити в пробірках 6-10. Додайте кілька мілілітрів хлоридної кислоти в пробірки 1-5 і кілька мілілітрів розведеної сульфатної кислоти (VI) в пробірки 6-10. На кожну трубку прикласти палючу шину. У пробірках, які містять магнієві стрічки та залізні, цинкові та нікелеві дроти, залиті кислотами, виділяються бульбашки газу. Найбільш інтенсивне виділення можна спостерігати в пробірках, що містять магній. Реакції, які відбуваються, такі: 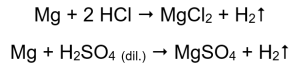 Кількість газу, що виділяється, зменшується в ряду: цинк, залізо, нікель. Відповідно відбуваються такі реакції:
Кількість газу, що виділяється, зменшується в ряду: цинк, залізо, нікель. Відповідно відбуваються такі реакції:  У трубках, які містили мідні дроти, газу не видно, ніяких змін. Це означає, що такі реакції не виникають:
У трубках, які містили мідні дроти, газу не видно, ніяких змін. Це означає, що такі реакції не виникають: 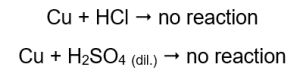 При накладенні палаючої шини в трубках, з яких виходить газ, чути характерний звук.
При накладенні палаючої шини в трубках, з яких виходить газ, чути характерний звук.
Підсумок спостережень і висновків:
Магній, цинк, залізо та нікель реагують як з соляною, так і з сірчаною кислотами (VI). Кожен з них витісняє водень із кислоти, що означає, що вони перебувають вище в ряду активності металів, ніж кислота. У результаті реакції утворюються продукти у вигляді солей і газу, водню, який виділяється. Характерний звук, який супроводжував прикладання палички до пробірки з витікаючим газом, викликаний реакцією водню з киснем. З усіх протестованих металів магній є найбільш реакційноздатним, за ним йдуть цинк, залізо, нікель і мідь. Ми можемо сказати, оскільки інтенсивність бульбашок газу вказує на активність металу. У пробірках, які містили мідь, змін не спостерігалося. Це показує, що мідь не здатна витіснити водень ні з соляної кислоти, ні з розбавленої сірчаної (VI) кислоти.

