При хімічних реакціях повне перетворення субстратів на продукти спостерігається лише для невеликої їх частини. Переважна більшість, включаючи ті, що відбуваються в нашому організмі, є оборотними. Для таких процесів встановлюється стан хімічної рівноваги. Це надзвичайно важливе поняття в хімії, яке пов'язане, наприклад, з принципом Ле Шательє (або Законом рівноваги). Знання основних законів і принципів хімічної рівноваги дозволяє, наприклад, передбачити багато реакцій або більш ефективно проводити технологічні процеси.
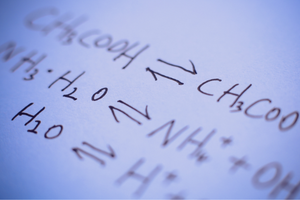
Оборотні та необоротні реакції
Беручи до уваги хід хімічних реакцій, можна зробити загальний поділ – на оборотні і необоротні реакції. Однак слід пам’ятати, що насправді 100%незворотних реакцій не буває, і віднесення до тієї чи іншої групи ґрунтується на переважаючому кінцевому ефекті.
Необоротні реакції
У цьому випадку субстрати в системі реагують і призводять до специфічних продуктів. Але зворотного перетворення – продуктів на субстрати не відбувається. У формулі одна стрілка позначена між реагентами, і стрілка вказує на продукти. Необоротні реакції — це насамперед усі ті, при яких утворюються осади. На практиці вони нерозчинні у воді і не можуть бути відновлені. Оборотність процесу також важко досягти у випадку реакцій, що відбуваються у відкритих системах, тобто в склянці або сферичній колбі, з яких один із утворених продуктів, наприклад вуглекислий газ, може вільно виходити, але змінюючи умови реакції, тобто перенісши її в закриту систему, можна зробити її оборотною. До групи необоротних реакцій належать також усі процеси, де взаємодія між молекулами продуктів відбувається значно меншою мірою, ніж між субстратами. Таким чином, такий процес відбувається в обох напрямках, але через те, що відновлення субстратів незначне, на практиці їх відносять до необоротних реакцій.
Оборотні реакції
Це реакції, під час яких із субстратів утворюються продукти і при цьому з порівнянною інтенсивністю відбувається зворотний процес – тобто відновлення субстратів із продуктів. У формулі реакції між реагентами розміщені дві стрілки, спрямовані в протилежні сторони, що вказує на оборотність реакцій, що відбуваються. До оборотних реакцій відносяться переважно ті, що здійснюються в закритих системах. Молекули субстратів і продуктів не можуть покинути реакційне середовище, і вони стикаються одна з одною, створюючи продукти і відновлюючи субстрати. Прикладом такої реакції є отримання йодистого водню з йоду та водню.
Стан хімічної рівноваги
Чи може відбуватися конкретна реакція, чи є вона оборотною чи необоротною, значною мірою залежить від конкретних умов процесу та типу процесу. Якщо відбувається оборотна реакція, тобто субстрати перетворюються на продукти в результаті хімічної реакції, і в той же час в результаті зіткнень молекул продуктів субстрати зазнають відновлення, то в якийсь момент часу, коли відбуваються ці реакції, встановлюється стан хімічної рівноваги . Іншими словами, концентрації субстратів і продуктів в системі знаходяться на постійному рівні – їх кількість не змінюється, незважаючи на безперервну реакцію. У стані хімічної рівноваги швидкості реакції в обох напрямках однакові. Під хімічною рівновагою за певних умов розуміється найбільш стійкий стан конкретної системи. Тоді потреба в енергії буде дуже низькою. Константа хімічної рівноваги K — це коефіцієнт, який описує рівновагу двох оборотних реакцій. Він визначається як частка концентрацій продуктів і субстратів у ступенях, що відповідають стехіометричним коефіцієнтам, які були виміряні в стані хімічної рівноваги. Формула константи була виведена в 1864 році як так званий закон дії мас. Слід пам’ятати, що це характерне значення для конкретної реакції. На стан хімічної рівноваги впливає ряд факторів. Ось деякі з них:
- температура,
- об’єм реакційної системи,
- тиск,
- концентрація реагентів.
Що важливо, на положення стану рівноваги не впливає додавання або зміна каталізатора реакції. Його завдання полягає лише в тому, щоб скоротити час, протягом якого досягається рівновага. 
Принцип Ле Шательє (закон рівноваги)
Змінюючи певні умови реакції, ми можемо впливати на її рівновагу. Система завжди буде прагнути підтримувати рівновагу, тому що це для неї енергетично вигідно (найменші витрати енергії). Як наслідок, відбудуться зміни, які протистоять факторам, що виводять систему з рівноваги. Це явище було пояснено в 1881 році і сьогодні відоме як принцип Ле Шательє-Брауна або як Закон рівноваги. Це дозволяє зрозуміти реакцію системи на зміни умов реакції, яка перебуває в стані хімічної рівноваги. Додавання до системи однієї з реагуючих речовин викликає порушення рівноваги. Змінюються концентрації окремих реагентів. Таким чином, щоб протидіяти цьому, система прагне виробляти більше продукту (якщо додано субстрат) або відновити субстрат (якщо додано певну кількість продукту). Зміна температури реакції має величезний вплив, особливо на ендотермічні та екзотермічні процеси. У першому випадку необхідно постачати енергію в систему у вигляді тепла, тому підвищення температури всього процесу зсуне рівновагу вправо (зниження вліво) у бік утворення більшої кількості продукту. . Протилежне буде для екзотермічних реакцій, де одним із продуктів є тепло. Температура не впливає на рівновагу реакції, де тепловий ефект не спостерігається. У випадку реакцій, що відбуваються в газовій фазі, тиск є дуже важливим аспектом. Збільшення значення цього параметра, тобто зменшення реакційного об’єму системи, призведе до зсуву рівноваги реакції. Напрямок змін залежить від стехіометричних коефіцієнтів у рівнянні реакції. Цей параметр не впливатиме на хімічну рівновагу реакції, в якій сума стехіометричних коефіцієнтів газоподібних субстратів і продуктів однакова. Варто пам’ятати, що коли систему виводять із хімічної рівноваги, спрацьовує Закон рівноваги, і в результаті буде досягнуто нового стану рівноваги.
